Облегчение - катодная реакция
Cтраница 1
Облегчение катодной реакции под тонкими пленками электролита связывается с уменьшением диффузионного ограничения в транспорте кислорода в зону реакции. [2]
Рост его концентрации приводит к облегчению катодной реакции и ускорению коррозионного процесса в целом. & ных частиц превышает число электронов, участвующих в катодном акте, восстановление окислителя сопровождается накоплением ОН-ионов в приэлектродном слое. Это приводит к изменению величины ( и даже знака) - потенциала и торможению как катодной, так и анодной реакций. [3]
Как показывают кривые катодной поляризации, резкое увеличение скорости коррозии в кислых средах вызвано облегчением катодной реакции восстановления водорода без изменения стационарных электродных потенциалов. В щелочной области повышение скорости коррозии сопровождается резким разбла-гораживанием потенциалов, что обусловлено растворением окисной пленки на поверхности сплава и переходом его в активное состояние. Коррозия металлов в сильно щелочных средах происходит за счет катодной реакции ионизации кислорода, поэтому потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не будет достигнуто перенапряжение реакции выделения водорода из молекулы воды, соответствующее катодной плотности тока при данном значении рН среды. [4]
В результате электрохимических исследований установлено, что увеличение скорости коррозии в кислых средах связано с облегчением катодной реакции восстановления водорода. В щелочной среде повышение скорости коррозии алюминиевых сплавов сопровождается резким разблагораживанием потенциалов, вызванным растворением окисной пленки на поверхности сплава и переходом его в активное состояние. В сильнощелочных средах потенциал активированной поверхности смещается в отрицательную сторону до тех пор, пока не достигается потенциал выделения водорода из молекул воды. [6]
 |
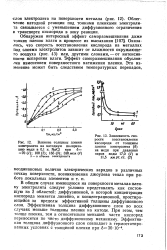
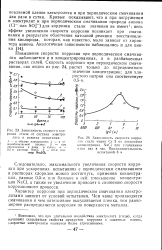
Зависимость стационарного потенциала коррозии стали 20 от степени пластической деформации 8 в различных средах. [7] |
Поскольку при нагреве скорость коррозии во всех исследованных средах увеличивается, облагораживание потенциала может быть связано только с преимущественным облегчением катодной реакции. [8]
Поскольку при нагреве скорость коррозии во всех исследованных средах увеличивалась, можно считать, что облагораживание потенциала связано только с преимущественным облегчением катодной реакции. [10]
Циркуляция воды и растворов во много раз увеличивает скорость коррозии, так как транспорт кислорода облегчается; если процесс протекает и при повышенных температурах, то скорость коррозии будет еще выше вследствие облегчения катодной реакции. [11]
Рассматривая с точки зрения пленочной теории коррозионное растрескивание двухфазных сплавов Al 77 % Mg, Жильберт и Хадден [106] полагают, что разрыв пленки на твердом растворе может увеличить скорость коррозии более анодной ( 3-фазы ( облегчение катодной реакции); наивысшая скорость растворения 3-фазы имеет место при одновременном разрыве пленки на твердом растворе и на самой р-фазе. [12]
Кривые показывают, что и при погружении в электролит и при периодическом смачивании природа аниона ( С1 - или SO) для коррозии стали значения не имеет1; весь эффект увеличения скорости коррозии возникает при смачивании в результате облегчения катодной реакции восстановления кислорода, которая, как известно, мало зависит от характера аниона. [14]
Отсюда можно заключить, что природа аниона ( SO42 или С1) как при полном погружении, так и в условиях периодического смачивания, для коррозии железа и цинка значения не имеет. Весь эффект в увеличении скорости коррозии при смачивании возникает в результате облегчения катодной реакции восстановления кислорода, которая, как известно, мало зависит от характера аниона. [15]
Страницы: 1 2