Облегчение - катодная реакция
Cтраница 2
 |
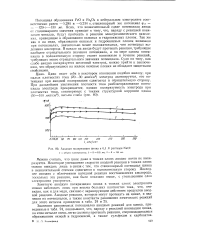
Кривые катодной поляризации. [16] |
Кривая при 20 С похожа на предыдущую, но проходит при более положительных значениях потенциала, что говорит об облегчении катодной реакции. Влияние повышения температуры на катодный процесс связано с увеличением константы реакции деполяризации и кислорода, принимающего участие в процессе деполяризации. Дальнейшее повышение температуры до 50 С смещает катодную кривую в область наиболее положительных зна-8 чений потенциала. При этом кривая приобретает характерный участок, который говорит о дальнейшем увеличении доли кислорода в процессе деполяризации и, собственно, подтверждает сам факт совместной ( кислородной и водородной) деполяризации. При повышении температуры до 80 С катодная кривая смещается в сторону более отрицательных значений потенциала, при этом величина предельного диффузионного тока уменьшается. Это можно объяснить понижением концентрации кислорода в растворе в связи с уменьшением его растворимости, так как константа реакции деполяризации продолжает расти при повышении температуры от 50 до 80 С. [17]
 |
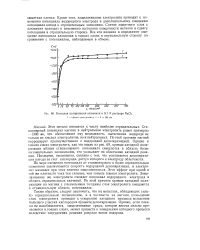
Анодная поляризация цинка в 0 1 N растворе NaCl. [18] |
Можно считать, что цинк даже в тонких слоях анодно почти не поляризуется. Некоторое уменьшение скорости анодной реакции в тонких слоях можно ожидать лишь в связи с тем, что стационарный потенциал цинка в незначительной степени сдвигается в положительную сторону Последнее связано с облегчением катодной реакции восстановления кислорода, поскольку эта реакция, как было показано выше, с утоньшением слоя электролита ускоряется. [19]
На стальном не оцинкованном образце без смазки в 5 % - ном растворе NaCl при рН 5 1 устанавливался потенциал коррозии - 681 мВ относительно насыщенного каломельного электрода. Потенциал коррозии такого же образца со споем смазки толщиной около 50 мкм в обоих растворах составлял - 592 мВ, т.е. был примерно на 9О мВ более положительным. Такое смещение потенциала коррозии в положительную сторону было обусловлено облегчением катодной реакции выделения водорода. [20]
Отсюда следует, что испытания изделий, предназначенных для эксплуатации в атмосферных условиях, необходимо проводить таким образом, чтобы металл подвергался возможно дольше действию тонких слоев электролитов. Подобные испытания к тому же более близки к естественным условиям эксплуатации изделий в атмосфере. Однако толщину пленки электролита на испытуемом металле нельзя бесконечно уменьшать, так как в очень тонких пленках наряду с облегчением катодной реакции может наступить вследствие концентрационных явлений резкое торможение анодной реакции, что замедлит коррозионный процесс. Выбор оптимальной толщины пленки, методы ее сохранения на поверхности и регулирование скорости реакций рассматриваются ниже при обсуждении отдельных методов испытаний. [21]
Шултин предложил следующий механизм растворения: при соприкосновении металла с раствором часть ионов металла, составляющая его кристаллическую решетку, лереходит в раствор, оставляя металлическую поверхность заряженной отрицательно; возникающий двойной электрический слой, внешнюю обкладку которого в первый момент составляют перешедшие в раствор ионы металла, через некоторое время может прекратить дальнейшее растворение. Однако в результате кинетического взаимодействия раствора часть ионов металла может быть заменена в двойном слое другими, присутствующими в растворе катионами. Если они имеют менее отрицательную природу, то неизбежно должны будут разрядиться и тем самым вызвать продолжение процесса растворения. Таким образом, роль постороннего включения может сводиться не к образованию элементов, а к облегчению катодной реакции вследствие понижения т ] н на них. [22]
Шултин предложил следующий механизм растворения: при соприкосновении металла с раствором часть ионов металла, составляющая его кристаллическую решетку, переходит в раствор, оставляя металлическую поверхность заряженной отрицательно; возникающий двойной электрический алой, внешнюю обкладку которого в первый момент составляют перешедшие в раствор ионы металла, через некоторое время может прекратить дальнейшее растворение. Однако в результате кинетического взаимодействия раствора часть ионов металла мо жет быть заменена в двойном слое другими, присутствующими в растворе катионами. Если они имеют менее отрицательную природу, то неизбежно должны будут разрядиться и тем самым вызвать продолжение процесса растворения. Таким образом, роль постороннего включения может сводиться не к образованию элементов, а: к облегчению катодной реакции вследствие понижения т ] На на них. [23]
Таким образом, учитывая, что необходимым условием коррозионных испытаний является ускорение контролирующей ступени процесса, а также то, что в нейтральных электролитах процесс коррозии, как правило, лимитируется скоростью кислородной деполяризации, для ускорения коррозионного процесса необходимо увеличивать скорость катодного процесса. Испытание изделий, предназначенных для эксплуатации в атмосферных условиях, необходимо проводить таким образом, чтобы металл подвергался возможно более длительному воздействию тонких слоев электролита. Подобные испытания к тому же более близки к естественным условиям эксплуатации изделий в атмосфере. Однако толщину пленки электролита на испытуемом металле нельзя бесконечно уменьшать, так как в очень тонких слоях наряду с облегчением катодной реакции может наступить вследствие концентрационных явлений резкое торможение анодной реакции, что замедлит коррозионный процесс. [24]
 |
Катодная поляризация алюминия в 0 1 Л растворе NaCl. [25] |
Этот металл относится к числу наиболее отрицательных. Стационарный потенциал магния в нейтральном электролите равен примерно - 1300 мв, что обеспечивает ему возможность вытеснения водорода не только из кислых электролитов, но и нейтральных. По этой причине магний корродирует преимущественно с водородной деполяризацией. Однако в тонких слоях электролита, как это видно из рис. 69, кривые катодной поляризации вблизи стационарного потенциала смещаются в область более положительных потенциалов, что указывает на облегчение катодной реакции. Последнее, несомненно, связано с тем, что усиливается деполяризация катода за счет кислорода, доступ которого к электроду облегчается. [26]
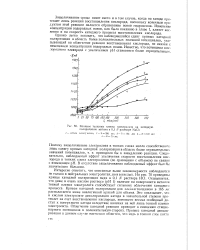 |
Влияние толщины пленки электролита на катодную поляризацию магния в 0 1 jV растворе NaCl. [27] |
Интересно отметить, что описанные выше закономерности наблюдаются не только в нейтральных электролитах, но и в кислых. Оказывается, что даже в очень кислом растЕоре ( рН 1) наличие на поверхности металла тонкой пленки электролита способствует сильному облегчению катодного процесса. Кривая катодной поляризации для пленки толщиною в 165 мк располагается ниже аналогичной кривой для объема. Это показывает, что в кислом электролите деполяризация катода в значительной степени протекает за счет восстановления кислорода, имеющего весьма свободный доступ к поверхности катода вследствие наличия на ней лишь тонкой пленки электролита. Облегчение катодной реакции приводит к смещению стационарного потенциала в положительную сторону. [28]
Страницы: 1 2