Обмен - ион - натрий
Cтраница 4
Предпосылкам, выдвинутым Корнфельдом и Ротмундом, Хисшенмелер35 противопоставил свои опыты по обмену основаниями натриево-аммониевых пермутитов; он очень быстро установил ложные равновесия и вызвал характерные процессы гистерезиса, ослабевавшие при повторных обменах и в конце концов переходившие в истинные равновесия. В частности, в старых пермутитах гистерезис исчезает уже после первого обмена основаниями. В реакциях обмена ионов натрия на ионы каль-дия гистерезис, однако, не исчезает окончательно даже при полном обмене. Основываясь а теоретических представлениях Вигнера, Дженни нашел пропорциональность между константами обмена, основаниями и ионным объемом. [46]
На рисунке представлена зависимость In ( 1 - F) от т ( прямая а) для Na-формы. Как видно из рисунка, экспериментальные точки удовлетворительно укладываются на прямую линию. Эти результаты свидетельствуют о том, что в случае обмена иона натрия на ион бутил-аммония скорость процесса обусловлена только пленочной кинетикой. [47]
В результате этих работ было показано, в частности, что поверхностная пленка кремневой кислоты образуется в результате обмена ионов натрия из стекла на ионы водорода из раствора. [48]
В большинстве случаев карбоксилсодержащий ионит применяют в солевой форме, заменяя ион водорода на ион натрия, кальция или аммония. В солевой форме сорбент полностью ионизирован и замещение однозарядного катиона на многозарядный происходит в нейтральной или даже слабокислой среде с достаточно высокой скоростью и полнотой. Так, например, скорость установления ионообменного равновесия при обмене иона водорода карбоксильной группы на ион калия составляет 7 дней, в то время как обмен иона натрия на ион кальция для того же сорбента длится всего 2 мин. Применение карбоксилсодержащих ионитов в процессах извлечения катионов из нейтральных или щелочных растворов тем более целесообразен, что поглотительная способность их в 2 - 3 раза превосходит емкость лучших образцов нерастворимых сульфокислот. [49]
При большом содержании полуторных окислов не наблюдается такой разницы в прочности связи ионов водорода и натрия в стекле, так как константа обмена приближается к значению, равному единице. Это можно приписать тому, что алюмо - и боросиликаты ведут себя в стекле, как соли сильных кислот. Постепенное повышение содержания этих окислов в стекле приводит к тому, что основные окислы ( натрия и кальция) связываются в первую очередь с алюмо - и боросиликатами, а остаток их остается связанным в простые силикаты. Константа обмена ионов натрия и водорода в таких стеклах должна будет иметь некоторое среднее значение, соответствующее пропорции между алюмо - или боросиликатами и простыми силикатами. [50]
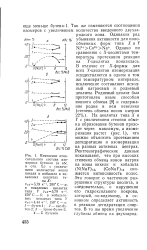 |
Изменение относительного состава изомерных бутенов ( в абс. и отн. % с увеличением количества ионов никеля и кобальта в никелевых цеолитах типа X. [51] |
В отличие от Х - формы для всех У-цеолитов изомеризация осуществляется в одном и том же температурном интервале, исключение составляют исходный натриевый и родиевый цеолиты. На цеолитах типа X и У с увеличением степени обмена образование бутенов проходит через максимум, а изомеризация растет ( рис. 1), что можно объяснить протеканием дегидратации и изомеризации на разных активных центрах. Рентгенографические данные показывают, что при высоких степенях обмена ионов натрия на ионы никеля и кобальта ( № ЫаУ) 12, ( СоКаУ) 12 снижается интенсивность полос. Это говорит о частичном разрушении структуры цеолита, а следовательно, о нарушении его гидроксильного покрова, который, по-видимому, в основном определяет активность в реакции дегидратации спиртов. [52]
В особенности это относится к ионам калия. В его присутствии ионы натрия менее действуют на потенциал стеклянного электрода. Это объясняется тем, что, хотя ион калия и не может свободно передвигаться в стекле, но он проникает в поверхностный слой стекла и затрудняет последующий обмен ионов натрия вследствие своей малой подвижности. Это было доказано рядом соответствующих опытов. [53]
Катионные формы цеолитов были получены из натриевой формы цеолита типа У ионным обменом при комнатной температуре. Образцы с высоким процентом обмена ионов натрия ( 90 % и выше) были получены повторным катионным обменом после прокаливания образцов при 550 С. Содержание иона Мп2 составляло примерно один ион на 12 5 элементарных ячеек или один ион на - 100 больших полостей. [54]
Пасынского, Авсеевича и мн. Никольский дал интересную термодинамическую теорию стеклянного электрода ( Журв. Химии 10, 495 - 523, 1937), согласно которой разность электрических потенциалов между стеклом и раствором обусловлена разностью химических потенциалов ионов водорода или натрия в пограничном слое стекла и в растворе. При установлении равновесия между тонким полимолекулярным слоем стекла у поверхности и раствором, в стекле идет обмен ионов натрия на ионы водорода, который определяется константой обмена ионов К. [55]
Обмен ионов натрия и серебра при электролизе стекол происходит очень быстро и проявляется в образующейся коричневой окраске стекла. Ионы калия ( и растворов хлористого калия или из расплавов роданистого калия при температуре 265 С) значительно труднее ввести в стекло, причем оно становится очень-хрупким. Если электролизу подвергается чистое калиевое стекло, то перенос ионов калия происходит быстро и металл откладывается на катоде. Однако замещение-натрия ионами лития всегда сопровождается осложнениями; стекло становится мутным и молочно-белым и неизбежно трескается, если электролиз продолжается достаточно долго. Но если мы имеем дело с литиевым стеклом, то электролиз протекает быстро. Кроме того, обмен ионов натрия и лития сильно изменяет внутреннее состояние стекла. [56]
 |
Состав исходных цеолитов. [57] |
Ионообменные свойства цеолитов известны давно [1], но изучены они еще недостаточно полно. Исследование ионообменных свойств цеолитов производилось в основном по отношению к металлическим ионам в солевых растворах, поскольку известно, что в кислотах цеолиты разрушаются. Однако при изучении обмена ионов и получении различных ионообменных форм цеолитов даже в солевых растворах следует иметь в виду возможность участия в обмене ионов водорода. Цеолиты могут рассматриваться как соли довольно слабых алюмокремниевых кислот. В силу одного этого возникает вопрос о необходимости изучения роли ионов водорода в обмене на цеолитах. Настоящая работа посвящена исследованию обмена ионов натрия и водорода на синтетических цеолитах. [58]
Исследовано обменное взаимодействие Na-Ca -, Ni - и А1 - форм монтмориллонита с растворами бутиламмонийхлорида. Установлено, что изотермы сорбции ионов бутиламмония на солевых формах глинистого минерала удовлетворительно описываются ( формально) уравнением Ленгмюра. Вычислены константы b этого уравнения, характеризующие адсорбируемость изученного органического катиона. Показано, что адсорбируемость ионов бутиламмония изменяется в зависимости от природы обменного катиона алюмосиликата. Для описания статического равновесия обмена в изученных системах было использовано также уравнение Никольского. Непостоянство найденных кажущихся констант обмена обусловлено в основном энергетической неоднородностью реальной поверхности глинистых минералов. Вычисленные значения изменения термодинамического потенциала процесса обмена свидетельствуют о том, что только в случае обмена ионов натрия на органические катионы энергия взаимодействия последних с поверхностью увеличивается, а на остальных изученных солевых формах минерала она уменьшается. [59]
Страницы: 1 2 3 4