Обмен - ион - водород
Cтраница 3
Са, равное 1 67, близко к наблюдаемому для большинства фосфатов циркония ( стр. Можно было предположить, что на апатитах возможен обмен ионов водорода и кальция, но в действительности этого не происходит. Следовательно, либо сродство иона водорода слишком велико, либо водород образует кова-лентные связи в структуре самого ионообменника. [31]
 |
Характеристика мембраны МК-40 в равновесном состоянии. [32] |
Время полунасыщения для систем указанного ряда соответственно равно: 5 9; 7 6; 11 5; 16 6; 19 1 мин. Однако, несмотря на то, что кинетика обмена иона водорода выше для одновалентных ионов, полной обменной емкости мембрана достигает при сорбции двухвалентных ионов. [33]
Ионообменными свойствами обладает также фторапатит [ Са5 ( РО4) з ] Р и гидроксилапатит [ Cas ( РО4) з ] ОН. Катионообменные свойства, например силикагеля, обусловлены - обменом ионов водорода гидроксильных групп на катионы металлов, проявляющимся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний. [34]
Ионообменными свойствами обладает также фторапатит ( Са5 ( РС4) з) Р и гидроксидапатит ( Са5 ( РС4) з) ОН. Катионообменные свойства, например, силикагеля, обусловлены обменом ионов водорода гидроксидных групп на катионы металлов, проявляющиеся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний. [35]
 |
Изменение содержания инверта в растворе мелассы в зависимости от температуры. [36] |
Из анализа результатов опытов видно, что инверсия сахарозы в растворах мелассы при контакте с катионитом в Н - форме происходит менее интенсивно, чем в чистых растворах сахарозы. Это объясняется тем, что в растворе мелассы происходит обмен ионов водорода на ионы Na, К, Mg, Са и другие катионы, и инверсия сахарозы происходит лишь за счет Н - ИОНОБ, перешедших в раствор. Этим как бы снижается роль катионита как катализатора. [37]
Полученные нами результаты показывают, что, по сравнению с другими катионитами на основе полимеров сурьмы, титаносурьмяные катиониты могут представить интерес для сорбции многозарядных ионов в нейтральных и щелочных растворах. Введение титана приводит, с одной стороны, в тому, что обмен ионов водорода начинается при более высоких рН, но, с другой стороны к увеличению сорбции многозарядных ионов. [38]
 |
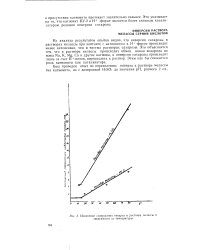
Зависимость емкости сорбции белков на смоле СБС в натриевой форме от ионной силы раствора ( концентрации NaCl. [39] |
Переход от одного типа ионообменных смол к другому или же изменение структуры ионита неизбежно влечет за собой и изменение особенностей в межмолекулярном взаимодействии белков с сорбентами в связи с возможностью участия различных функциональных групп в образовании комплекса сорбент-сорбат. В связи с этим следует отметить, что наиболее удачными смолами, позволяющими оценивать кулоновское межмолекулярное взаимодействие с участием цвиттерионов, являются сульфосмолы, для которых константа обмена ионов водорода и натрия близка к единице. Именно на этих смолах сопоставление емкости сорбции на водородных и натриевых формах m дает более строгую информацию об электрических особенностях строения белков. В случае карбоксильных смол очень большую роль при сорбции белков играет и дополнительное, некулоновское взаимодействие. Доказательством важной роли кулоновского взаимодействия при сорбции белков суль-фосмолами и наличия явления электростатического отталкивания, наблюдаемого при этом на натриевых формах смол, служит изучение экранирования зарядов белковых молекул в сорбционных опытах. Приведенные на рис. 1 кривые показывают, что повышение ионной силы раствора вызывает усиление сорбируемости сульфосмолой СБС в натриевой форме не только сывороточного альбумина, - глобулина, но и инсулина. [40]
 |
Зависимость емкости сорбции белков на смоле СБС в натриевой форме от ионной силы раствора ( концентрации NaCl. [41] |
Переход от одного типа ионообменных смол к другому или же изменение структуры ионита неизбежно влечет за собой и изменение особенностей в межмолекулярном взаимодействии белков с сорбентами в связи с возможностью участия различных функциональных групп в образовании комплекса сорбент-сорбат. В связи с этим следует отметить, что наиболее удачными смолами, позволяющими оценивать кулоновское межмолекулярное взаимодействие с участием цвиттерионов, являются сульфосмолы, для которых константа обмена ионов водорода и натрия близка к единице. Именно на этих смолах сопоставление емкости сорбции на водородных и натриевых формах дает более строгую информацию об электрических особенностях строения белков. В случае карбоксильных смол очень большую роль цри сорбции белков играет и дополнительное, некулоновское взаимодействие. [42]
Более детальная трактовка природы изменений смол в результате термической обработки требует разрешения ряда вопросов с применением физико-химических методов исследования. К числу таких вопросов следует отнести выяснение роли воды в процессе десульфирования смол на воздухе, потенциометрическое исследование влияния термической обработки на природу ионогенных групп сульфокатионитов и изучение кинетики обмена ионов водорода в смолах полимеризационного типа на органические ионы большого радиуса. [43]
В своем обширном исследовании, предпринятом в 1955 г., Райхенберг и Маккоули [2] при изучении селективности катионов с 5, 10, 15 и 25 % ДВБ по отношению к ионам водорода, лития, натрия и калия пришли к выводу, что отдельные ионообменные участки в ионитах нельзя считать полностью идентичными и что самой вероятной причиной такой неоднородности является различное число поперечных связей в зерне ионита. Возможно, в действительности число поперечных связей широко и непрерывно изменяется по зерну ионита, но для простоты Райхенберг и Маккоули разделили ионит на три области: 1) область с малым числом поперечных связей, куда могут проникать полностью гидратированные ионы и где селективность невысока; 2) область со средним числом поперечных связей, в которой размер иона может иметь решающее значение, и 3) область с большим числом поперечных связей, где энергия гидратации ионов будет главным фактором, определяющим селективность. Обмен ионов водорода не соответствует полностью этой картине; возможно, это объясняется тем, что ионы водорода взаимодействуют с ионитом особым образом, например с образованием свободной ковалентной связи, что характерно для области третьего типа, где ионы водорода могут быть частично дегидратированы. [44]
Использование уравнения ( 1) требует предварительного знания величин констант обмена ионов РЗЭ и констант устойчивости соответствующих комплексов. Поскольку константа обмена ионов водорода на аммоний на сульфокатионитах близка к единице, такое допущение не вносит существенной ошибки. [45]
Страницы: 1 2 3 4