Ионный обмен
Cтраница 2
Ионный обмен в аналитических целях проводят обычно в динамических условиях. В нижнюю часть ионообменной колонки помещают стеклянную вату или впаивают пористую стеклянную пластинку для задержания мелких частиц ионита. Для заполнения колонки отбирают отсеиванием частицы подходящего для задач исследования ионита размером 0 1 - 0 3 мм. Более мелкие частицы затрудняют прохождение растворов через колонку, а более крупные снижают емкость колонки. [16]
Ионный обмен впервые был открыт и изучен около ста лет назад, когда было найдено, что некоторые глинистые минералы почвы могут удалять калиевые и аммонийные соли из воды, причем одновременно в воду переходит эквивалентное количество соответствующей соли кальция. В то время было найдено и изучено много природных ионообменных веществ ( ионитов), и большинство из них являются неорганическими. [17]
Ионный обмен - это обычно обратимый и стехиоэдетрический процесс, однако как положение равновесия, так и скорость реакции зависит от многих факторов. [18]
Ионный обмен в органическом анализе используется для тех же целей, что и в неорганическом анализе. Помимо методов хроматографиче-ского разделения смесей известны способы удаления мешающих ионов, определения общей концентрации ионных форм в смесях, концентрирования следовых количеств веществ. [19]
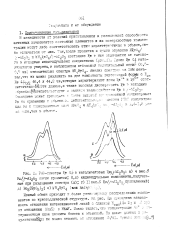
Ионный обмен приводит к. На рис. 2д приведена зависимость отношения интенсивностей линий с близкой &... [21]
Ионный обмен основан на применении специально изготовленных зернистых материалов - катионитов и анионитов. Катиони-ты - это практически нерастворимые в воде соли или кислоты, катион которых способен вступать при определенных условиях в обменную реакцию с катионами раствора. Таким образом, катио-нит сорбирует из раствора катионы, заменяя их на эквивалентное количество катионов, которыми он был предварительно заряжен. Аниониты - это основания или соли, анионы которых способны к обмену с анионами раствора. После проведения регенерации ка-тиониты и аниониты готовы к следующему циклу работы. [22]
Ионный обмен, основанный на различном сродстве компонентов смеси к смоле, широко используется как метод разделения [93-94], поэтому теоретически его можно применять для определения содержания различных частиц в смеси. Однако будучи прекрасным методом для качественных исследований, ионный обмен неудобен и неточен для количественного определения констант устойчивости. [23]
Ионный обмен представляет собой процесс взаимодействия раствора с твердой фазой, обладающей свойствами обменивать ионы, содержащиеся в ней, на другие ионы, присутствующие в растворе. Вещества, составляющие эту твердую фазу, носят название ионитов. Те из них, что способны поглощать из растворов электролитов положительные ионы, называются катеонитами, отрицательные ионы - анионитами. Первые обладают кислотными свойствами, вторые - основными. Если иониты обменивают и катионы, и анионы, их называют амфотерными. Поглотительная способность ионитов характеризуется обменной емкостью, которая определяется числом эквивалентов ионов, поглощаемых единицей массы или объема попита. Различают полную объемную, статическую и динамическую емкости. [24]
Ионный обмен происходит в эквивалентных отношениях и в большинстве случаев является обратимым. Реакции ( ионного обмена лротекают вследствие разности химических потенциалов обменивающихся ионов. [25]
Ионный обмен можно проводить в среде метилового, этилового, изопропилового спиртов или в смеси спирта с другим органическим растворителем в зависимости от растворимости анализируемого соединения. Спирты проявляют слабые дифференцирующие свойства, поэтому в качестве растворителей более желательны для дифференцированного титрования кетоны, но они могут оказывать разрушающее действие на катиониты и, кроме того, ионный обмен в среде кетонов протекает не полностью. Поэтому ионный обмен обычно проводят в среде спиртов, а при титрО Вании выделенных кислот добавляют ацетон или метилэтилкетон. Можно проводить ионный обмен в среде спирт - кетон при содержании кетона в смеси не более половины. [26]
Ионный обмен в неводных средах дает возможность определять индивидуальные соли, которые не могут быть определены в водной среде; например, соли, подвергающиеся гидролизу; соли, кислоты которых нерастворимы в воде. [27]
 |
Схемы отстойников конструкции Центроэнергочермета для выделения некристаллизующейся ( а и тяжелой кристаллизующейся взвесей ( б. [28] |
Ионный обмен имеет некоторое сходство с адсорбцией: в обоих случаях твердое тело поглощает растворенное вещество. Принципиальное различие между ними состоит в том, что ионит взамен поглощенных ионов отдает в раствор эквивалентное количество противоионов с таким же знаком заряда, а адсорбент только поглощает растворенное вещество, не отдавая в раствор другого. Несмотря на четкое различие, на практике нередко трудно провести границу между названными процессами, поскольку ионный обмен почти всегда сопровождается адсорбцией. [29]
 |
Дозы реагентов ( мг / л для дезактивации воды известково-содовым методом.| Дезактивирующая способность ионитов. [30] |
Страницы: 1 2 3 4