Эквивалентный ионный обмен
Cтраница 1
 |
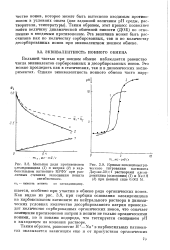
Изотерма сорбции аланина. [1] |
Эквивалентный ионный обмен в кислотной среде ( при рН pK0i) изучен для ряда аминокислот и пептидов с использованием изотермы эквивалентного ионного обмена. Представленные на рис. 3.51 зависимости коэффициентов избирательности ионного обмена от мольной доли аминокислоты ( глицина) и дипептида ( глицилфенил-алапина) в ионите показывают, что для аминокислоты коэффициент избирательности мал и незначительно меняется при увеличении количества противоионов в ионите. [2]
 |
Изотерма сорбции аланина. [3] |
Как и для эквивалентного ионного обмена, протекающего с участием ионов органических веществ, процесс непосредственной сорбции диполярных ионов, состоящий в превращении водородной формы резината в аминокислотную, сопровождается ростом энтропии системы. [4]
Ниже излагается теория метода для самого общего случая ионного обмена с существенным поглощением ионитом коионов ( сверх эквивалентный ионный обмен) с участием произвольного числа сортов противоионов и коионов, для произвольной шкалы концентраций и произвольного выбора стандартных состояний. [5]
 |
Изотерма сорбции аланина. [6] |
Эквивалентный ионный обмен в кислотной среде ( при рН pK0i) изучен для ряда аминокислот и пептидов с использованием изотермы эквивалентного ионного обмена. Представленные на рис. 3.51 зависимости коэффициентов избирательности ионного обмена от мольной доли аминокислоты ( глицина) и дипептида ( глицилфенил-алапина) в ионите показывают, что для аминокислоты коэффициент избирательности мал и незначительно меняется при увеличении количества противоионов в ионите. [7]
Для рассмотрения динамики ионного обмена с участием разно-валентных ионов необходимо найти вид динамической изотермы на основе совмещения уравнений изотермы ионного обмена, постоянства обменной емкости и эквивалентного ионного обмена. [8]
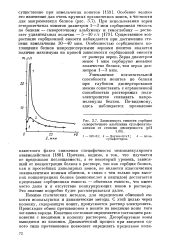 |
Зависимость емкости сорбции сывороточного альбумина сульфокатио-нптами от степени дисперсности ( рН. [9] |
Причина, видимо, в том, что изучается не предельная поглощаемость, а ее некоторый уровень, зависящий от концентрации белков в растворе, так как сорбция белков, как и простейших диполярных ионов, не является классическим эквивалентным ионным обменом, в связи с чем только при высоких концентрациях белков ( аминокислот и пептидов) достигается предельная сорбционная емкость - обменная емкость, что имеет место даже и в отсутствие конкурирующих ионов в растворе. Это явление подробно будет рассматриваться далее. [10]
Таким образом, этот процесс позволяет найти величину динамической обменной емкости ( ДОЕ) по отношению к вводимым противоионам. Эта величина может быть рассчитана как по количеству сорбированных, так и по количеству десорбированных ионов при эквивалентном ионном обмене. [12]
Во второй работе Арланда и других [252] описано отделение плутония и продуктов деления от облученного урана. Взаимодействие ионов уранила в водных растворах с силикагелем было исследовано также Стэнтоном и Ма-атманом [ 253а ], подтвердившими наличие эквивалентного ионного обмена. В лаборатории автора настоящей статьи эквивалентный обмен был замечен также между аэросилом и уранилацетатом. Это несколько удивительно, поскольку средние расстояния между силанольными группами значительно больше, чем размер ионов уранила, и поэтому должен был бы наблюдаться эквимолярный обмен. Возможно, что пары силанольных групп всегда находятся на расстояниях, совпадающих с размером иона уранила. [13]
Иная возможность открывается при рассмотрении ионообменных процессов с участием резинатов. Следует отметить, что при использовании моделей резинатов отпадает необходимость однотипной стандартизации компонентов в растворе и в ионите. Далее, при эквивалентном ионном обмене, когда флуктуация соответствует малому смещению именно стехио-метрического ионного обмена, можно исключить работу электрических сил, так как в подобном процессе она полностью компенсируется перемещением ионов в прямом и обратном направлении между фазами. [14]
Однако существуют иониты и ионообменные системы, для которых целесообразно описание равновесия с учетом двух состояний резинатов. Прежде всего к ним относятся слабые катиониты и аниониты, в частности карбоксильные катиониты. Как уже было показано в предыдущих разделах этой главы, обменная емкость карбоксильных катионитов зависит от рН внешнего раствора. Следовательно, лишь часть ионогенных групп способна замещаться противоионами, находящимися в растворе. Это подтверждается, в частности, динамическими ( колоночными) экспериментами. При фильтровании через карбоксильный катионит в водородной форме раствора электролита с определенным значением рН происходит замещение лишь части атомов водорода карбоксильных групп на вводимый катион в полном соответствии с данными, полученными при определении обменной емкости методом потенциометрического титрования в растворе той же ионной силы с основанием того же противоиона. Если рассматривать два типа противоионов, основания которых дают один и тот же вид кривых титрования, то обмен этих ионов можно считать эквивалентным ионным обменом на ионизированных ионогенных группах, концентрация ( количество) которых определена обменной емкостью и зависит от ионной силы раствора. [15]
Страницы: 1