Оболочка - атом
Cтраница 1
Оболочка атома состоит из электронов. Электроны при соответствующих условиях ( при возбуждении) могут отрываться от атома и переноситься на большое ( теоретически бесконечно большое) расстояние. Это используется в радиотехнике и электротехнике. Так, например, движение электронов по проводам представляет собой электрический ток. [1]
В оболочке атома С имеется группировка 2s22 / A Из нее оба р-электрона пошли на образование двух ковалентных связей с атомом О, а два электрона конфигурации 2s2 в данном случае остаются неиспользованными. Последний, взаимодействуя с вакантными d - орбиталями оболочек атомов переходных металлов VI, VII и в особенности VIII групп, образует своеобразные комплексные соединения - карбонилы металлов. Наиболее известны среди них: Fe ( CO) 3 - пентакарбонил железа ( гл. [2]
В оболочке атомов многих элементов один s - электрон с внешнего энергетического уровня п 1 как бы падает на d - подуровень ближайшего более низкого уровня п, тем самым увеличивая ранее имевшееся там число d - электронов на один: ( s - ( - переходы. Схематически это представлено в левой части таблицы В. [3]
Какой оболочке атома Т1 ( К, L, L2, L3) соответствует каждая группа. [4]
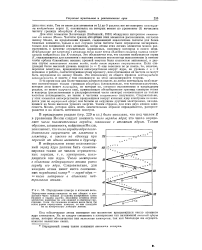 |
Порядковые номера и атомные веса. [5] |
Под оболочками атома понимают все множество вращающихся около атомного ядра электронов. Их не следует смешивать с электронами так называемой внешней сферы атома, которые обозначаются как валентные электроны, так как благодаря им осуществляются валентные связи. [6]
Дальтона ( теплородные оболочки атома), К. Л. Бертолле ( изменение состояния атома данного элемента в различных его соединениях), К - Раммельсберга ( изменение состояния атома при переходе его в различные изоморфные тела) и было призвано объяснить индивидуальные свойства соединений. [7]
Электронная - оболочка атома фосфора состоит из трех слоев. [8]
Во 1внешней оболочке атома азота недостает до полного октета трех электронов: при образовании трех ковалентных связей такой октет достигается. [9]
Формулы электронного строения оболочек атомов построены по энергетическому признаку. Однако не следует полагать, что эти формулы пространственно отображают какие-то стационарные системы: в атоме все бурлит под непрерывным воздействием центробежных и центростремительных сил в их единстве и противоположности. Особенно это проявляется в отношении валентных электронов. Например, в атоме калия ( К, Z 19) валентный электрон 4s1 то втягивается ядром и электрон на мгновение внедряется в атомный остов калия ( пенетрация), то дружным действием одноименно заряженных электронов остова выбрасывается из последнего. Получается, что 4 1-электрон как бы описывает по периферии атома замкнутую своеобразную синусоиду. [10]
Если до заполнения оболочки атома не хватает одного электронат то такую систему можно рассматривать как систему с движущейся дыркой в заполненной оболочке. [11]
Самое существенное свойство оболочки атома определяется тем, что атом состоит из частиц, несущих противоположные электрические заряды: из положительно заряженного ядра ( описание тонкого строения которого выходит за пределы вопросов, рассматриваемых в настоящей книге) и отрицательно заряженных электронов, число которых может достигать ста. В незаряженном атоме электроны компенсируют заряд ядра; если число электронов меньше или больше числа зарядов ядра, то имеется заряженный атом, или атом-ион. [12]
Большая часть электронов оболочки атома тесно связа на с ядром и не покидает его. Другая часть электронов оболочки слабо связала с ядром и при определенных условиях легко покидает атом. Такие электроны называют валентными. [13]
Порядок заселения электронами оболочек атомов определяет его электронную конфигурацию. [14]
Массой электронов в оболочке атома можно пренебречь по сравнению с массой ядра и считать, что масса атома равна массе его ядра. [15]
Страницы: 1 2 3 4