Оболочка - атом
Cтраница 2
Электроны находятся в оболочке атома, и их распределение в ней непосредственно определяет химические и физические свойства элементов. Строение оболочки обусловливает также образование и природу химической связи. Порядковый номер атома в периодической системе совпадает с числом электронов в оболочке незаряженного атома, которые компенсируют заряд ядра; если число электронов меньше или больше числа зарядов ядра, то образуется заряженный атом, атом-ион. [16]
Подобно электрону в оболочке атома каждый нуклон - протон и нейтрон характеризуется четырьмя квантовыми числами, и, в соответствии с принципом Паули, эти характеристики яе могут полностью совпадать у любых двух нуклонов: каждый нуклон имеет свой набор квантовых чисел. Квантовое число п определяет величину энергии ядерного уровня, а квантовое число 1, отвечающее вращательному, или орбитальному моменту нукяона, позволяет внести некоторую поправку в величину энергии нуклона. [17]
Сколько электронов в оболочке атомов элементов: лития, азота, неона, магния, серы, хлора, кальция, алюминия, хрома. Сколько в каждом из них валентных электронов и в каких электронных слоях они находятся. Какую наибольшую положительную валентность проявляет элемент. Чему равна отрицательная валентность элемента. [18]
Причина: в оболочках атомов ныне известных элементов фактически застраиваются не все теоретически возможные подуровни. [19]
Если с А - оболочки атома удален электрон, то образовавшаяся вакансия может заполниться электроном из L-оболочки. Переход L-К сопровождается излучением ( флуоресценция), или это безрадиационный переход, при котором освободившаяся энергия может пойти на выброс электрона с одной из вышележащих оболочек, например М - оболочки. Этот процесс, известный под названием оже-эффекта, преобладает над флуоресценцией в области легких элементов. Оже-линии обычно сопровождают рентгеноэлект-ронные спектры. Поскольку оже-выброс является результатом вторичных процессов, не зависящих от энергии падающего фотона, если только она достаточна для ионизации / ( - оболочки, то одни и те же оже-электроны могут обнаруживаться при различных энергиях источника. Действительно, оже-спектры получают с различными источниками возбуждения в рентгеноэлектронных экспериментах. [20]
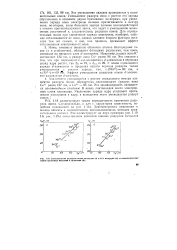 |
Сопоставление радиусов ионов металлов IA и ПА подгрупп ( а и изоэлектронных ионов щелочных металлов и галогенов ( б. [21] |
Ионы, имеющие внешние оболочки атомов благородных газов ( s и р-оболочки), обладают большими радиусами, чем ионы, имеющие во внешнем слое d - электроны. Например, радиус иона К составляет 133 пм, а радиус иона CLI равен 96 пм. Эффект уменьшения радиусов ионов d - элемен-тов называется d - сжатием. [22]
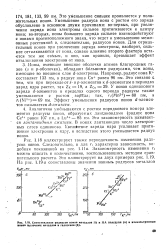 |
Сопоставление радиусов ионов металлов IA и ПА подгрупп ( а и изоэлектронны ионов щелочных металлов в галогенов ( б. [23] |
Ионы, имеющие внешние оболочки атомов благородных газов ( s и р-оболочки), обладают большими радиусами, чем ионы, имеющие во внешнем слое d - электроны. Например, радиус иона К составляет 133 пм, а радиус иона Си равен 96 пм. У ионов одинакового заряда d - элементов в пределах одного периода радиусы также уменьшаются с ростом заряда; так, г ( Мп2) 80 пм, а r - ( Ni2) 69 пм. Эффект уменьшения радиусов ионов d - элемен-тов называется d - сжатием. [24]
Формула III предполагает наличие десятиэлектронной оболочки атома серы. [25]
Движение электронов, составляющих оболочку атомов, непрерывно. Электроны вращаются в атоме на различных расстояниях от ядра. Они как бы образуют несколько слоев, составляющих в целом всю оболочку атома. Каждый слой заполнен определенным числом электронов. [26]
 |
Схемы строения атомов элементов, имеющих заряд ядра 1 - 18. [27] |
Движение электронов, составляющих оболочку атомов, непрерывно. Электроны вращаются в атоме на различных расстояниях от ядра. Они как бы образуют несколько слоев, составляющих в целом всю оболочку атома. Каждый слой заполнен определенным числом электронов. Электроны одного слоя характеризуются почти одинаковым запасом энергии. Поэтому говорят, что они находятся на одинаковых энергетических уровнях. Распределение электронов по отдельным слоям ( энергетическим уровням) в оболочке атома подчиняется следующей закономерности: наибольшее число электронов, возможное в данном слое, равно удвоенному квадрату номера слоя: 2л2, где п - номер слоя, считая от ядра. [28]
Количество валентных электронов в оболочке атома, как правило, численно равно номеру группы, в которой находится данный элемент. Оно определяет собой максимально высокое окислительное число этого элемента. [29]
Почему количество электронов в оболочке атома не является числом, характеризующим атом. Какое же число характеризует атом. [30]
Страницы: 1 2 3 4