Электронная оболочка - молекула
Cтраница 1
Электронные оболочки молекул с четным числом электронов ( два, четыре) г, основном состоянии, как правило, являются замкнутыми. [1]
Электронная оболочка молекулы имеет слоистое строение. Она состоит из определенных дискретных электронных групп, причем структура электронной оболочки молекулы регулируется теми же законами, что и структура электронной оболочки атома. Электронная оболочка одной молекулы не может глубоко проникнуть в электронную оболочку другой, так как и электроны, и ядра отталкиваются друг от друга. [2]
 |
Полосатый спектр.| Молекулярный спектр водорода. [3] |
Электронная оболочка молекулы образуется в результате слияния электронных оболочек атомов, входящих в состав молекулы. [4]
Возбуждение электронной оболочки молекулы оказывает сильное воздействие на водородную связь. Баланс скоростей образования и диссоциации частично или полностью протонированных оснований ( что зависит от глубины протониро-вания - степени внедрения протона в электронную оболочку основания) определяет константу равновесия реакции кислотно-основного взаимодействия, или, другими словами, - силу кислоты в данном растворителе, выступающем в роли основания. [5]
Перекрывание электронных оболочек молекул приводит к образованию химических связей, подобных обычным ковалентным связям, но значительно менее прочных. Возникающие при этом ассоциаты часто называют молекулярными комплексами. [6]
Понятие жесткость электронной оболочки молекулы можно рассматривать как выраженный в терминах теории МО эквивалент понятия поляризуемость, который мы обсуждали в разд. [7]
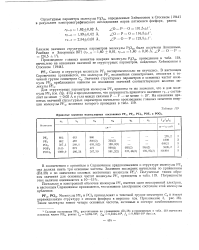 |
Принятые значения молекулярных постоянных PF2, PF3, PC13, POF3 и РОС13. [8] |
Поскольку в электронной оболочке молекулы PF2 имеется один неспаренный электрон, в настоящем Справочнике принимается, что основное электронное состояние этой молекулы дублетное. [9]
 |
Молекулярные л-орбитали 1 3 -бутадиена. [10] |
Бугадиен отличается более лабильной электронной оболочкой молекулы по сравнению с алкенами и алкинами: его потенциалы ионизации ниже, а электронное сродство выше, чем у изученных до сих пор углеводородов. [11]
 |
Энергетическая диаграмма граничных молекулярных орбиталей и значения жесткости ( Г электронных оболочек ряда углеводородов. [12] |
Бутадиен отличается более лабильной электронной оболочкой молекулы по сравнению с алкенами и алкинами: его потенциалы ионизации ниже, а электронное сродство выше, чем у изученных до сих пор углеводородов. [13]
Таким образом, электронная оболочка молекулы не только испытывает модуляцию в результате колебаний ядер, но и сама, будучи поляризована полем световой волны, воздействует на ядра, вызывая увеличение амплитуды их колебаний. [14]
Таким образом, электронная оболочка молекулы не только испытывает модуляцию в результате колебаний ядер, но и сама, будучи поляризована полем световой волны, воздействует на ядра, вызывая увеличение амплитуды их колебаний. [15]
Страницы: 1 2 3 4