Образование - общая электронная пара
Cтраница 2
Это, конечно, обязательное условие для образования общей электронной пары из двух электронов. Они должны непременно иметь противоположный спин. [16]
В случае ( а) оба атома участвовали в образовании общей электронной пары, в случае ( б) общая электронная пара возникла за счет электронов одного атома. Исходя из механизма образования комплексных соединений, можно дать им более точное, не имеющее исключений, определение: комплексные соединения - это соединения, характеризующиеся наличием хотя бы одной донорно-акцепторной связи. [17]
В первом случае ( а) оба атома участвовали в образовании общей электронной пары, во втором случае ( б) общая электронная пара возникла за счет электронов одного атома. [18]
В первом случае ( а) оба атома участвовали в образовании общей электронной пары, во втором случае ( б) общая электронная пара возникла за счет электронов одного атома. Таким образом, силы комплексообразования не отличаются от обычных валентных сил, разница имеется лишь в механизме их возникновения. [19]
В первом случае ( а) оба атома участвовали в образовании общей электронной пары, во втором случае ( б) общая электронная пара возникла за счет электронов одного атома. Таким образом, природа химических сил и в этом случае не отличается от обычных валентных сил. Донорно-акцепторная связь отличается от ковалентной лишь своим происхождением. [20]
Суть атомной связи в органических соединениях в том, что для образования общей электронной пары каждый атом-партнер поставляет по одному электрону со своей наружной оболочки. Общее число электронов остается, таким образом, неизмененным, но у каждого атома возникает конфигурация электронов, аналогичная оболочке благородного газа. [21]
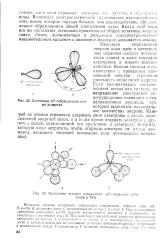 |
Состояние р3 - гибридизации это ма углерода.| Появление четырех одинаковых 5р3 - гибридных орби-талей в МНз. [22] |
Возникает электростатическое кулоновсксе взаимодействие этих ионов, которое гораздо больше, чем взаимодействие, обусловленное образованием общей электронной пары. Вклад этой пары все же составляет несколько процентов от общей величины энергии связи. Связь, возникающая в результате электростатического взаимодействия катионов и анионов в молекуле, называется, ионной. [23]
Химическая связь образуется при перекрывании электронных облаков двух атомов, образующих связь, или, упрощенно, при образовании общей электронной пары. Этот процесс сопровождается выделением энергии. Электронная пара может находиться на одинаковом расстоянии от центров атомов, образующих связь. Если же электронная jnapa смещена к одному из атомов, возникает полярная ковалентная связь. В случае полного перехода электронной пары к одному из атомов образуется положительный и отрицательный ионы, и связь между ними называется ионной. [24]
Современная теория валентности не проводит резкой границы между ионной и ковалентной связью. Та и другая рассматриваются как результат образования общей электронной пары из электронов, принадлежащих атомам обоих элементов. Разница заключается лишь в том, что в случае ионной связи электронная пара переходит полностью к одному из атомов. Поэтому понятие о положительной и отрицательной валентности заменяется общим понятием об окислительном числе атома. Это число положительное, если при образовании молекулы электроны сместились от данного атома, и отрицательное, если они сместились к данному атому. [25]
 |
Энергетическая диаграмма образования а - связи в молекуле Hj. [26] |
По методу валентных связей при сближении двух атомов водорода происходит перекрывание их s - орбиталей, каждая из которых содержит один электрон. Этот процесс сопровождается выделением энергии при образовании общей электронной пары. Поскольку между положительно заряженными ядрами атомов водорода действуют силы электростатического отталкивания, то, начиная с некоторого расстояния между атомами, эти силы начинают препятствовать дальнейшему самопроизвольному сближению атомов. Таким образом, образованию ковалентной связи отвечает состояние молекулы Hj с энергетическим минимумом ( выигрышем энергии) в 436 кДж / моль. [27]
В атоме фтора во внешнем слое находится семь электронов. Для образования молекулы фтора FZ каждый из атомов фтора отдает по одному электрону на образование общей электронной пары, вследствие чего оба атома в молекуле фтора приобретают электронную конфигурацию ближайшего инертного газа - неона. Атомы азота, имеющие во внешнем слое по пяти электронов, при соединении в молекулу образуют три общие электронные пары. И в этом случае атомы в молекуле приобретают устойчивую вось-миэлектронную оболочку. [28]
Подобно Косселю, он считал, что при химическом взаимодействии атомы стремятся приобрести конфигурацию внешней электронной оболочки последующего благородного газа. Только, по Льюису, это достигается не отдачей и присоединением электронов, а образованием общей электронной пары. Каждый из взаимодействующих атомов отдает по одному электрону на образование указанной электронной пары, если возникает одинарная связь. [29]
Подобно Косселю, он считал, что при химическом взаимодействии атомы стремятся приобрести конфигурацию внешней электронной оболочки последующего благородного газа. Только, по Льюису, это достигается не отдачей и присоединением электронов, а образованием общей электронной пары. Каждый из взаимодействующих атомйв отдает по одному электрону на Образование указанной электронной пары, если возникает одинарная связь. [30]
Страницы: 1 2 3