Образование - пассивирующая пленка
Cтраница 3
Стали трубные углеродистые Ст. В нитрозной серной кислоте эти стали стойки ( III-IV группа) благодаря образованию пассивирующей пленки; поэтому чугунные трубы, работающие на нитрозной кислоте, в настоящее время заменяются стальными. [31]
 |
Временные изменения электрического тока в аморфном сплаве Pd - 16Ti - 19Р при постоянном потенциале 1 5 В в 4 н. водном растворе NaCl ( pH 1 5. [32] |
Интересно, что хотя в начальный период за счет действия хлора пассив иру-ющая пленка разрушается, активное растворение Bice равно восстанавливает пассивное состояние. Обобщая, можно сказать, что в сильных коррозионных средах активное растворение является важным условием образования пассивирующей пленки. При циклическом возникновении пассивирующей пленки в сильных окислительных средах активное растворение сплава приводит к тому, что растворяются те же элементы, которые почти не влияют на формирование пленки, а элементы, влияние которых существенно, напротив, не растворяются, но скапливаются у поверхности раздела с водным раствором, улучшая тем самым защитные свойства пленки. Следовательно, если в сплавах, содержащих такие элементы, как хром, которые способствуют образованию пассивирующей пленки и улучшают ее защитные свойства, скорость активного растворения повышается, то указанные элементы накапливаются у поверхности раздела, причем их накопление ускоряется, а это, в свою очередь, ускоряет и формирование пассивирующей пленки. [33]
Все эти факты приводят к выводу, что ионы циана являются основным фактором, способствующим упрочнению пассивирующей пленки. На основании приведенных данных трудно указать, каким путем взаимодействие металла с цианидами приводит к образованию пассивирующей пленки. Возможно, что одной из причин этого является изменение произведения растворимости комплексной соли с увеличением концентрации цианистого калия в прикатодном слое. На растворимость цианистых комплексов, очевидно, может оказывать также влияние изменения степени гидратации ионов в двойном электрическом слое и в прилегающей к нему части диффузионного слоя. [34]
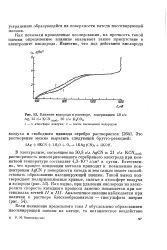 |
Влияние водорода в растворе, содержащем 48 г / л. [35] |
В электролите, состоящем из 30 8 г / л AgCN и 21 г. л KCNCB06, растворимость неполяризованного серебряного электрода при комнатной температуре составляет 4 3 - 10 - 3 г / см2 в сутки. Естественно, что процесс ионизации металла приводит к повышению концентрации AgCN у поверхности катода и тем самым может способствовать образованию пассивирующей пленки. [36]
Для понимания механизма анодного растворения марганца необходимо определение точных значений анодных потенциалов, измерение которых обычным путем вследствие образования пассивирующих пленок не дает достоверные результаты. Получение более точных анодных потенциалов возможно: а) путем непрерывного удаления пассивирующей пленки с анода в процессе измерения; б) проведением измерений в условиях, задерживающих образование пассивирующей пленки; в) настолько быстрыми измерениями, что поверхность анода успевает лишь незначительна измениться. [37]
Советскими исследователями была доказана возможность и обязательная необходимость замены свинца в башенных системах чугуном и сталью. Коррозия чугуна и стали в 73 - 76 % - ной серной кислоте, обычно применяемой в башенных системах, с повышением температуры и нитрозности кислоты падает, что объясняется образованием пассивирующей пленки. [38]
При этом еле дует помнить, что на поверхности, пассивированной хромовым ангидридом или концентрированным щелочным раствором, фосфатное покрытие формируется медленно. Нитритная обработка способствует образованию мелкокристаллического покрытия. Проникая через поры в покрытии, соединения хрома ( VI) окисляют не закрытые фосфатным слоем мельчайшие участки на поверхности металла с образованием пассивирующей пленки. [39]
Вредными примесями в электролитах оловянирования являются прежде всего металлы с потенциалом более положительным, чем олово, ионы которых, присутствуя в очень малых количествах, восстанавливаются при предельном токе с образованием губчатых осадков на катоде. К таким примесям относятся прежде всего мышьяк, сурьма, медь, причем щелочные станнатные электролиты более чувствительны к примесям, чем кислые. Вредное влияние на качество осадков оказывает также присутствие в станнатных электролитах железа и свинца. Считают [3, 46], что загрязнение электролита железом препятствует образованию пассивирующей пленки на оловянных анодах. Такое же влияние оказывают примеси нитратов и хлоридов в станнатном электролите. [40]
Местная коррозия при малом повреждении большей части поверхности приводит, к появлению кратерообразных углублений ( язв), превращающихся затем в сквозные отверстия. Язвы и пит-тинги образуются преимущественно под бугорками ржавчины и посторонними примесями, вблизи уровня электролита, под пузырьками воздуха и каплями. Образование язв ограничивается отдельными участками поверхности, где покровный слой недостаточен, порист или поврежден. Оно распространяется дальше в тех агрессивных средах, где поверхность находится в условиях начальной стадии образования пассивирующей пленки или в условиях частичной ликвидации ранее существовавшей пленки. [41]
Интересно, что хотя в начальный период за счет действия хлора пассив иру-ющая пленка разрушается, активное растворение Bice равно восстанавливает пассивное состояние. Обобщая, можно сказать, что в сильных коррозионных средах активное растворение является важным условием образования пассивирующей пленки. При циклическом возникновении пассивирующей пленки в сильных окислительных средах активное растворение сплава приводит к тому, что растворяются те же элементы, которые почти не влияют на формирование пленки, а элементы, влияние которых существенно, напротив, не растворяются, но скапливаются у поверхности раздела с водным раствором, улучшая тем самым защитные свойства пленки. Следовательно, если в сплавах, содержащих такие элементы, как хром, которые способствуют образованию пассивирующей пленки и улучшают ее защитные свойства, скорость активного растворения повышается, то указанные элементы накапливаются у поверхности раздела, причем их накопление ускоряется, а это, в свою очередь, ускоряет и формирование пассивирующей пленки. [42]
Образовавшиеся частицы оксида магния осаждаются на поверхности мелких капель металла и увлекают их в шлам. Попадание оксида магния на катод вызывает его пассивацию. На количестве осаждаемого металла сказывается состояние стальной поверхности катода. Чистая поверхность катода хорошо смачивается магнием и на ней образуются крупные капли осажденного металла. Образование пассивирующей пленки на катоде, состоящей в основном из оксида магния и дисперсного железа, способствует образованию мелких корольков металла. Покрытые оксидом магния корольки уносятся в анодную зону, где постепенно окисляются хлором. Добавки фторидов кальция и натрия благоприятствуют образованию более крупных капель магния за счет десорбции оксида магния с мелких частиц металла. Пассивную пленку очищают механически или посредством выделения щелочного металла на катоде при электролизе обедненного электролита. После очистки катода и добавки свежей порции хорошо обезвоженного электролита выделяющийся магний вновь смачивает поверхность катода. [43]
Как это было показано выше, при нормальных температурах коррозионные среды ( электролиты) влияют на прочность стали в связи с возникновением адсорбционных и электрохимических явлений, причем в случае коррозии с водородной деполяризацией приобретает значение диффузия водорода в сталь. При высоких температурах ( например, в расплавах солей) превалирующее значение при влиянии коррозионной среды на прочность уже имеют не электрохимические и адсорбционные явления, а диффузионные процессы, в результате которых может наблюдаться растворение стали ( особенно легирующих ее элементов), либо образование твердых растворов, например азотирование стали, либо возникновение интерметаллических соединений. Как известно, качество коррозионной среды при нормальных температурах определяется такими ее свойствами, как концентрация водородных ионов в растворе ( значением рН), концентрация раствора ( С %), насыщенность среды кислородом и др. Все электролиты при комнатных температурах снижают усталостную прочность стали при циклическом нагружении, причем чем агрессивнее среда, тем значительнее снижение. При длительном действии статического нагру-жения не все коррозионные среды вызывают коррозионное растрескивание стали, причем оно почти не зависит от агрессивности среды. Интенсивность общей коррозии также не пропорциональна агрессивности среды, что объясняется образованием пассивирующей пленки из окислов на поверхности стали, причем, обычно чем больше агрессивность, тем быстрее образуется эта пленка. [44]
Страницы: 1 2 3