Образование - полугидрат
Cтраница 1
 |
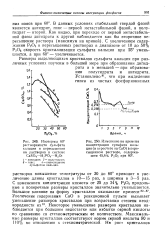
Значение коэффициентов в уравнении Для дегидратации гипса. [1] |
Образование полугидрата, а также нерастворимого ангидрита из CaSO4 - 2H2O в водной среде объясняется разной растворимостью этих модификаций сульфата кальция при различных температурах. При температуре 315 К и выше создаются необходимые условия для перехода двуводного гипса в ангидрит и его стабильного существования. Однако практически такой переход наблюдается лишь в присутствии в водной среде кристаллов ангидрита. [2]
В случае образования полугидрата сульфата кальция трубопроводы и фильтры могут забиваться осадком этой соли, которая перекристаллизовывается при понижении температуры. Поэтому стремятся поддерживать такой режим процесса производства фосфорной кислоты, при котором CaSO4 - 0 5H2O гид-ратируется перед фильтрацией и промывкой. По указанным причинам пересыщение жидкой фазы сульфатом кальция нежелательно и в дигидратном процессе, так как вызывает необходимость частой очистки аппаратов и технологических коммуникаций. [3]
Недостатком указанного способа является образование неустойчивого полугидрата. Отмывка его от фосфорной кислоты практически невозможна, как и очистка водой фильтровальной ткани или перегородки. Химическая регенерация последних также исключается из-за отсутствия пригодного растворителя. Поэтому длительная работа фильтровального материала фильтров или центрифуг вряд ли может быть осуществлено. [4]
Недостатками этого процесса является образование неустойчивого полугидрата сульфата кальция вследствие чего невозможна отмывка его от фосфорной кислоты, а также очистка водой фильтровальной ткани или перегородки. Химическая их регенерация также исключается из-за отсутствия пригодного растворителя Поэтому представляется трудно осуществимой длительная кампания фильтровального материала фильтров или центрифуг. Помимо этого получаемая фосфорная кислота загрязнена монокальцийфос-фатом и имеет недостаточно высокую концентрацию ( - 42 5 % PzOs), что в некоторой степени ограничивает области ее применения. [5]
 |
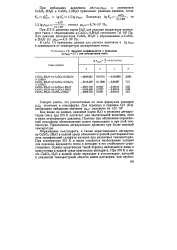
Политермы растворимости сульфатов кальция в растворах фосфорной кислоты. [6] |
Однако он весьма быстро разлагается с образованием полугидрата. [7]
Заводской строительный гипс-обжигаемый при температурах более высоких, чем теоретически необходимые для образования полугидрата, содержит кроме полуводного гипса также и растворимый ангидрит. При некоторых способах производства ( высокие температуры обжига в течение очень небольшого промежутка времени) в продукте обжига может оказаться нерастворимый ангидрит. [8]
Заводской строительный гипс, обжигаемый при температурах более высоких, чем теоретически необходимые для образования полугидрата, содержит кроме полуводного гипса также и растворимый ангидрит. При некоторых способах производства ( высокие температуры обжига в течение очень небольшого промежутка времени) в продукте обжига может оказаться намертво обожженный гипс. Несмотря на то, в производственных условиях прибегают к более высоким температурам, из-за кратковременности процесса обжига в строительном гипсе может содержаться и двуводный гипс; присутствие его ускоряет сроки схватывания, так как при затворении водой он создает центры кристаллизации. [9]
Первое кипение гипсового порошка наблюдается при темпе - ратуре 413 - - 423 К и характеризуется в основном образованием полугидрата. Образую-щийся при дегидратации гипса пар направляется из котла в пыле-осадительные устройства для улавливания имеющейся в нем пыли, а затем в очищенном виде вместе с отходящими газами удаляется в атмосферу. Гипсовый порошок возвращается в бункер сырого молотого гипса. [10]
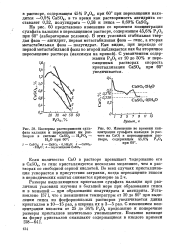 |
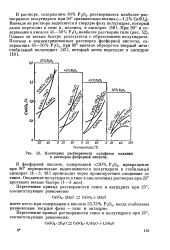
Изотермы растворимости суль.| Изменение во времени концентрации сульфата кальция ( в расчете на СаО в пересыщенном растворе, содержащем 45 6 % РаОв при 60. [11] |
Размеры выделяющихся кристаллов сульфата кальция при различных условиях изучены в большей мере при образовании гипса и в меньшей - при образовании полугидрата и ангидрита. Установлено [57 ], что с повышением температуры от 30 до 80 при выделении гипса из фосфорнокислых растворов увеличивается длина кристаллов в 10 - 15 раз, а ширина их в 3 - 5 раз. С изменением концентрации кислоты от 25 до 34 % Ра06 продольные и поперечные размеры кристаллов значительно уменьшаются. [12]
Размеры выделяющихся кристаллов сульфата кальция при различных условиях изучены в большей мере при образовании дигидрата и в меньшей - при образовании полугидрата и ангидрита. [14]
Страницы: 1 2