Образование - малодиссоциированное соединение
Cтраница 3
Наиболее широко применяющаяся в настоящее время методика бихромат-ной окисляемости предусматривает добавление сульфата серебра в начале реакции окисления, причем предполагается, что сульфат серебра играет не только роль катализатора, но и связывает хлор-ионы с образованием малодиссоциированного соединения AgCl, чем предотвращается реакция окисления хлор-ионов. [31]
Наиболее широко применяющаяся в настоящее время методика бихроматной окисляемости предусматривает добавление сульфата серебра в начале реакции окисления, причем предполагается, что сульфат серебра играет не только роль катализатора, ио и связывает хлор-ионы с образованием малодиссоциированного соединения Аа CI, чем предотвращается реакция окисления хлор-ионов. [32]
Наиболее широко применяющаяся в настоящее время методика бихроматной окисляемости предусматривает добавление сульфата серебра в начале реакции окисления, причем предподагает-ся, что сульфат серебра играет не только роль катализаторе, ио и связывает хлор-ионы с образованием малодиссоциированного соединения Аа CI, чем предотвращается реакция окисления хлор-ионов. [33]
При потенциометрическом титровании цинка ферроцианидом калия ионы цинка не участвуют в процессе установления потенциала платинового электрода. При образовании малодиссоциированного соединения K2Zn3 [ Fe ( CN6) ] 2 в процессе титрования до эквивалентной точки концентрация анионов [ Fe ( CN) e 1 значительно меньше, чем концентрация анионов [ Fe ( CN) e ] 3, и в соответствии с установившимся соотношением концентраций этих ионов потенциал платинового электрода принимает определенное значение. В конце реакции осаждения цинка в растворе появляется избыток K4 [ Fe ( CN) 6 ], который дает резкое изменение потенциала системы [ Fe ( CN) 6P - / [ Fe ( CN) e ] 4 -, и скачок потенциала платинового электрода указывает на точку эквивалентности. [34]
При потенциометрическом титровании цинка ферроцианидом калия ионы цинка не участвуют в процессе установления потенциала платинового электрода. При образовании малодиссоциированного соединения K2Zn3 [ Fe ( CN) 6 ] 2 в процессе титрования до эквивалентной точки концентрация анионов [ Fe ( CN) J - ] значительно ниже, чем концентрация анионов, и соответственно установившемуся соотношению концентраций этих ионов потенциал платинового электрода принимает определенное значение. По окончании реакции осаждения цинка в растворе обнаруживается избыток К4 [ Fe ( CN) 6 ], дающий резкое изменение потенциала системы [ Fe ( CN) 6 ] 3 - / [ Fe ( CN) 6 ] 4 -, и соответственно скачок потенциала платинового электрода указывает на точку эквивалентности. [35]
Кривые потенциометрического титрования могут быть построены так же и для методов, основанных на реакциях осаждения и комплексообразования. Концентрацию определяемого иона вычисляют с учетом образования малодиссоциированных соединений. [36]
Сопоставляя гидролиз KCN и NaC2H3O2, мы видели, что в первом случае он заходит значительно дальше, чем во втором. Различие вызвано тем, что гидролиз зависит от образования малодиссоциированных соединений. [37]
Комплексонометрия - титриметрический метод, основанный на реакциях взаимодействия определяемых ионов с некоторыми органическими реактивами. Ионы металлов практически мгновенно взаимодействуют с комплексонами с образованием растворимых малодиссоциированных соединений постоянного состава. [38]
Ионы металлов практически мгновенно взаимодействуют с комплексонами с образованием растворимых малодиссоциированных соединений постоянного состава. [39]
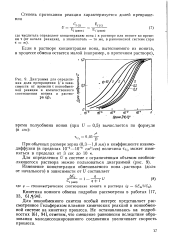 |
Диаграмма для определения доли превращения U в зависимости от времени т ионообменной реакции и количественного соотношения ионита и раствора ( д. [40] |
Для ионообменного синтеза особый интерес представляет рассмотренное Гельферихом влияние химических реакций в ионообменной системе на кинетику процесса. Не останавливаясь на подробностях [61, 94], отметим, что смещение равновесия вследствие образования малодиссоциированного соединения увеличивает скорость процесса. [41]
Это возможно тогда, когда в малодиссоциированном соединении ионы связаны прочнее, чем в осадке. В результате то небольшое количество ионов, которое находится в растворе в равновесии с осадкам, связывается с образованием малодиссоциированного соединения. Из осадка в раствор переходят новые порции ионов, которые, в свою очередь, тоже образуют малодиссоциированное соединение. В конечном итоге осадок растворяется. Следовательно, при растворении малорастворимого соединения и образовании малодиссоциированного соединения играет роль как ПР первого, так и константа диссоциации второго. [42]
Колориметрическое и спектрофотометрическое определение состоит из двух этапов: переведения определяемого компонента в соединение, поглощающее свет, и измерения оптической плотности раствора. Полнота переведения определяемого компонента в соединение, поглощающее свет, зависит от концентрации реагирующих компонентов. Для образования прочного малодиссоциированного соединения не требуется большого избытка реактива; в этом случае для уверенности в полноте связывания определяемого компонента достаточно прибавить полуторный избыток реактива. Однако в фотометрических методах анализа часто применяют сравнительно малопрочные комплексные соединения: роданидные, галогенидные и др. В таких случаях степень связывания в сильной мере зависит от концентрации избытка реактива. [43]
Во всех случаях они протекают в сторону уменьшения числа свободных конов. Уменьшение числа свободных ионов происходит при образовании малорастворимых, легколетучих и малодиссоциированных соединений. [44]
Эта реакция сопровождается образованием хлорида магния и водорода. Следовательно, данная реакция протекает только в одном направлении и поэтому называется необратимой. К необратимым процессам относятся реакции, сопровождающиеся образованием малодиссоциированных соединений, а также те, конечные продукты которых удаляются из реакционной среды. [45]
Страницы: 1 2 3