Образование - комплексное соединение
Cтраница 1
Образование комплексных соединений между попами металлов и молекулами ( так называемыми аддендами) чревато глубокими преобразованиями электронной оболочки, что зачастую видно невооруженным глазом по образованию из бесцветных веществ ярко окрашенных продуктов. Переход полос поглощения света из ультрафиолетовой в видимую область означает глубокую перестройку электронных орбит, связывающих атомы. [1]
Образование комплексных соединений с нейтральными молекулами приводит к стабилизации низших состояний окисления - элементов. [2]
Образование комплексных соединений большей частью усиливает окраску веществ, так как при этом происходит смещение электронных уровней заместителя ( донора общей электронной пары) и образование новых электронных уровней, близких по энергии к первоначальным уровням координирующихся атомов. [3]
Образования комплексных соединений не обнаружено. [4]
Образование комплексных соединений может быть объяснено как с точки зрения электростатических сил взаимодействия между ионами, так и с точки зрения образования электронных пар, как это имеет место в соединениях с ковалентной связью. [5]
Образование комплексных соединений в виде промежуточных продуктов реакции с последующим распадом их на конечный продукт реакции и исходный катализатор не объясняет всех деталей механизма этой реакции. Для выяснения истинного механизма реакций алкилированпя следует обратиться к современной теории кислотного катализа. Кислотные свойства хлористого алюминия в настоящее время более или менее доказаны. Известно, что во всех реакциях с хлористым алюминием присутствуют следы влаги и хлористого водорода. [6]
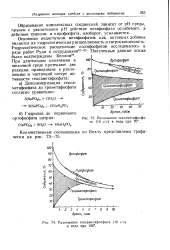 |
Разложение гексаметафосфата ( 10 г / л в воде при 70.| Разложение гексаметафосфата ( 10 г. л в воде при 100. [7] |
Образование комплексных соединений зависит от рН среды, причем с увеличением рН действие метафосфата ослабевает, а действие Триполи - и пирофосфата, наоборот, усиливается. [8]
Образование комплексных соединений всегда происходит с участием d - орбиталей. Так как из четырех электронов, размещенных на трех орбиталях - Рх Ру и PZI Два обязательно должны быть спарены ( принцип Паули), атом серы в основном состоянии является двухвалентным потому, что в образовании связей могут принимать участие только неспаренные электроны. Объясняется такая возможность двумя причинами. Во-первых, возмущение в поле окружающих молекул приводит к тому, что внешняя d - орбиталь оказывается сильно сжатой и энергетически мало отличается от существующей внешней оболочки. С другой стороны, образование связующих внешних орбиталей с примесью d - орбиталей, как впервые показал Полинг [15], приводит к образованию очень четко направленных и сильных связей. [9]
Образование комплексного соединения из простых веществ обусловлено уменьшением энергии Гиббса в процессе комплексообразованкя. [10]
Образование комплексных соединений зависит от природы и концентрации иона комплексообразователя. В табл. 3 показана сорбция ряда переходных металлов из растворов их аммиачных комплексов анионитами на основе ПЭПА. [11]
Образование комплексных соединений с борной кислотой является практическим методом определения конфигурации некоторых стеребйзомерных гликолем. [12]
Образование комплексных соединений дивинила с солями одновалентной меди используют для отделения дивинила от остальных С4 - угле-водородов. В 1935 г. найдено, что дивинил очень легко количественно выделить из смеси с я-бутиленами с помощью поглощения аммиачным раствором полухлористон меди. [13]
Образование комплексных соединений не ограничивается алифатическими эфирами. [14]
Образование комплексных соединений большей частью усиливает окраску веществ, так как при этом происходит смещение электронных уровней заместителя ( донора общей электронной пары) и образование новых электронных уровней, близких пс энергии к первоначальным уровням координирующихся атомов. [15]
Страницы: 1 2 3 4