Образование - сульфид
Cтраница 1
Образование сульфидов отрицательно сказывается на гидрата-ционной активности цементов. [1]
Образование сульфида 3S является обычно первой стадией при технической переработке природных сульфатов Са, Sr и Ва на другие их соединения. [2]
Образование сульфида Э5 является обычно первой стадией при технической переработке природных сульфатов Са, Sr и Ва на другие их соединения. [3]
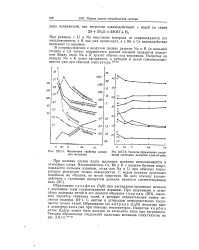 |
Физические свойства щелоч - [ IMAGE ] ХЩ-2. Теплоты образования соеди-ных металлов. нений щелочных металлов ( ккал / г-экв. [4] |
Образование сульфида ( Э25) при растирании щелочного металла с порошком серы сопровождается взрывом. С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида ( Li3N) медленно идет в атмосфере азота уже при обычных температурах. Напротив, карбид лития ( LJ2C2) может быть получен из элементов лишь при нагревании. [5]
Образование сульфида ( Э25) при растирании щелочного металла с порошком серы сопровождается взрывом. С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида ( LbN) медленно цдет в атмосфере азота уже при обычных температурах. [6]
 |
Ход изменения физических свойств щелочных металлов. [7] |
Образование сульфида ( Э25) при растирании щелочного металла с порошком серы сопровождается взрывом. С азотом и углеродом непосредственно соединяется только литий. Образование его нитрида ( Li3N) медленно идет в атмосфере азота уже при обычных температурах. [8]
Образование сульфида кремния по реакции ( 4) начинается при 1100 С и заканчивается при 1450 С. Кремнезем, содержащийся в боксите, на 50 % переходит в SiS2, а остальное количество его восстанавливается до кремния и переходит в ферросплав. Восстановление окиси кремния по реакции ( 2) начинается при температуре 1585 С. Образовавшийся при этом сульфид кремния почти полностью улетучивается. [9]
Образование сульфида калия протекает количественно, если по окончании реакции очень медленно ( в течение нескольких часов) испарять NH3 через трубку, наполненную гидро-ксидом калия. Аммиачный раствор при этом должен оставаться бесцветным, а сульфид калия выделяться в виде белого осадка. Остаток аммиака испаряют особенно медленно, чтобы избежать распыления вещества по стенкам сосуда. Полученный препарат откачивают длительное время на масляном насосе и прокаливают в течение 1 / 2 ч при 400 - 500 С. Кристаллы измельчают встряхиванием реакционного сосуда и, наклонив прибор, пересыпают в пробирки 6, которые отпаивают под вакуумом или азотом. Этим методом получается очень чистый сульфид калия. Выход продукта почти количественный. [10]
Образование сульфидов переходных металлов особенно важно в процессах получения синтетических топлив. Многие реакции проводятся при высоких концентрациях сероводорода, поэтому требуются катализаторы, которые устойчивы в такой среде. Это особенно важно для гидросероочистки. В других реакциях ограничения по сере также являются жесткими. По-видимому, во время реакции многие катализаторы находятся в суль-фидированном или частично сульфидированном состоянии. [11]
Возможно образование сульфидов и из холодных растворов или за счет осаждения тяжелых металлов сероводородом, или путем восстановления сернокислых растворов. [12]
Вследствие образования сульфида серебра продол, жительность выщелачивания сокращается с 2 ч до 7 мин, возрас. При этом предотвращается отри, цательное влияние элементарной серы, образующейся при выще. [13]
Закономерности образования сульфидов и окислов металлов при термохимическом разложении сульфатов марганца и железа / / йурн. [14]
Теплота образования сульфида Со25з из элементов составляет 40 ккал / моль. [15]
Страницы: 1 2 3 4