Образование - циклопентан
Cтраница 1
Образование циклопентанов, в отличие от циклопропанов и циклобутанов, при изомеризации - парафинов доказано экспериментально как на кислотных, так и на бифункциональных катализаторах. Поэтому представления о промежуточном образовании цикла расширены на основе предположений о возможности замыкания С-атомов углеродной цепи не только в трех -, но и в четырех - и пятичленные циклы, причем в этом же порядке облегчается образование циклов. [1]
Из сопоставления термодинамических данных по теплотам образования циклопентана, циклогексана, циклопентанола, циклопентанона и циклогексанона авторы нашли, что наибольшая разница получается при образовании циклопентанона из Циклопентана и циклогексанона из циклогексана соответственно - 28 74 и 26 17 ккал / моль. Это значит, что при введении одной и той же СН2 - группы в 5-членное и 6-членное кольца получается разница в 2 6 ккал / моль за счет растяжения молекулы. Авторы считают, что эта разница может объяснить относительно высокую енолизацию циклогексанона, которая находит свое отражение и в его реакционной способности. Концентрация енолов IB полярных растворителях должна быть больше, чем в неполярных. [2]
Следует заметить, что близкие выводы о путях образования циклопентанов из алканов в присутствии алю-моплатинового катализатора сделаны нами в работе [111], в которой также был применен кинетический изотопный метод. [3]
Вывод относительно строения илида был сделан лишь на основании метода синтеза, данных микроанализа и образования циклопентана триметиламина при его гидрировании. Триме-тилциклопентиламмониевые соли не были обнаружены. Илид, по-видимому, реагирует с различными электрофильными реагентами: йодистым метилом, пикриновой кислотой, сулемой, бромом, однако ни разу не удалось выделить каких-либо идентифицируемых продуктов. [4]
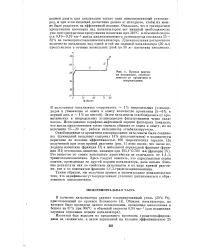 |
Кривая разгонки катализата, освобожденного от ароматики и непредельных. [5] |
Таким образом, мы получили прямое и окончательное доказательство того, что парафины могут в определенных условиях циклизоваться с образованием циклопентанов. [6]
В последнее десятилетие в литературе особо широко обсуждаются механизмы реакций гидрогенолиза цикло-алканов, скелетной изомеризации алканов и циклоалка-нов, дегидроциклизации с образованием циклопентанов и аренов в присутствии металлических катализаторов. Отличительной особенностью современного подхода к механизмам обсуждаемых реакций является тенденция рассматривать их с общих позиций, в основе которых лежит рассмотрение переходных состояний, близких по строению или даже одинаковых сразу для нескольких реакций. Такие возможности возникают, когда условия благоприятствуют параллельному протеканию нескольких реакций, что для каталитических превращений углеводородов наблюдается довольно часто. Действительно, как показано ниже, результаты, полученные при исследовании механизма гидрогенолиза циклопентанов, непосредственно связаны с закономерностями протека-ни я ряда других реакций, в первую очередь реакций Сз-дегидроциклизации и скелетной изомеризации алканов. [7]
Предполагают, что реакция протекает путем сопряженного присоединения изонитрильного комплекса 3-иодпропилмеди к а § - ненасыщенному эфиру с последующей циклизацией путем внутримолекулярного алкилиро-вания с образованием циклопентана и изонитрильного комплекса галогенида меди. Вместо 1 3-дииодпропана может быть использован 3 3-бис ( иодметил) оксетан ( 62), что приводит к соответствующему оксаспирановому производному. Лучшими субстратами в этих реакциях являются иодиды; при использовании бром - и хлорпроизводных циклические продукты получаются с низким выходом. [8]
В этих условиях наблюдались следующие реакции: гидрогенолиз пентана с образованием метана, этана и бутана, изомеризация в изопен-тан и С5 - дегидроциклизация с образованием циклопентана. Для циклизации наблюдается насыщение, что авторы объясняют достижением равновесия; реакции изомеризации и гидрогенолиза не лимитируются равновесием. Скорость изомеризации ( Vi) гораздо меньше зависела от дисперсности металла и в определенном интервале мало снижалась при увеличении размера кристаллитов. [9]
Циклогексан в процессе гидрогенизации при 470 - 490 % С и трехчасовой продолжительности опыта изомеризуется в метилцик-лопентан, который в свою очередь отщепляет метильную группу с образованием циклопентана и метана. [10]
Можно полагать, что сырье, из которого получен бензин 2, содержит преимущественно нафтеновые углеводороды, лишенные свободных циклопентильных групп, способных к отрыву при термическом распаде сложных циклических молекул с образованием циклопентана и циклопентена. [11]
При Cs-дегидроциклизации алканов и Cs-циклизации алкенов на Pt / Al2O3 показано [84, 126], что скорость реакции в отсутствие Н2 быстро падает, доходя фактически до нуля, и наоборот, в токе Н2 проходит успешная циклизация как алканов, так и алкенов. Роль водорода при образовании циклопентанов в присутствии алюмоплатиновых катализаторов с низким содержанием Pt пока недостаточно ясна. Возможно, что влияние водорода на протекание реакции осуществляется по нескольким направлениям, часть которых обсуждалась выше. Не исключая этих возможностей и в случае нанесенных Pt-катализаторов, следует также обсудить ассоциативный механизм действия водорода [84], представляющийся авторам книги одним из наиболее вероятных. В этих реакциях водород входит в состав переходного комплекса, образующегося на поверхности катализатора по ассоциативной схеме. [12]
Процесс, приводящий к постадийному обмену, по-видимому, идет на центрах Рв плоскости ( 111), хотя рассмотрение с точки зрения теории молекулярных орбит [12] указывает на вероятную затрудненность образования адсорбированных форм, связанных многократной связью с этой поверхностью, на которой нет также центров, прочно хемосорбирующих атомы водорода. Процесс, избирательно ведущий к образованию циклопентана - d &, по-видимому, идет на центрах Р8, находящихся на плоскости ( 100), так как в этом случае связи с адсорбированными молекулами образуются легче. Полный многократный обмен, вероятно, идет на реберных центрах В5 ( НО), поскольку они представляют наилучшую возможность для образования адсорбированных форм, связанных с поверхностью многократными связями; в то нее время здесь имеются центры для умеренно сильной адсорбции атома водорода. [13]
В скобках даны теплоты образования ДЯ ( в ккал / молъ) при 25 С. Эти величины для диметилциклопропана и диметилциклобутана были оце-нены из сравнения теплот образования циклопентана и диметилциклопента-на и соответственно циклогексана и диметилциклогексана. [14]
Совместно с А. Л. Либерманом и О. В. Брагиным Б. А. Казанский показал, что к С5 - дегидроциклизации способны не только парафины, но и алкилбензолы, превращающиеся в индан и его гомологи. На основании полученных данных был сделан вывод, что С5 - дегидроциклизация углеводородов на Pt / C идет по секстетно-дублетному механизму по схеме: алкан - - циклан; последующее развитие этих исследований показало, что и на Pt / Al2O3 образование циклопентанов хотя бы частично проходит путем прямого замыкания пятичленного цикла. [15]
Страницы: 1 2