Электрохимическое образование
Cтраница 2
Процесс химического или электрохимического образования на поверхности металла защитной пленки, состоящей из фосфатов металлов, называется фосфатированием. [16]
Существует несколько вариантов механизма электрохимического образования пероксоборатов. Первый предусматривает, что пероксоборат получается окислением на аноде метабората параллельно с ионами ОН - с образованием свободных радикалов. [17]
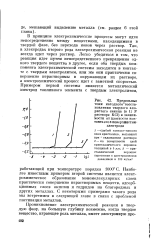 |
Предельные токи катодного восста-новления твердого хлористого свинца ( в 1 ] N растворе КС1 в зависимости от плотности контакта его с поверхностью-электрода. [18] |
Наиболее известным примером второй системы является электрохимическое образование мономолекулярных слоев практически совершенно нерастворимых веществ, адсорбционных слоев окислов и гидридов на благородных и других металлах. [19]
В слабокислом растворе основным процессом является электрохимическое образование анилина, которому, однако, несколько препятствуют побочные реакции. [20]
Этот метод применим к любому процессу электрохимического образования или превращения фазы, в котором необходимо исследовать вновь осажденное вещество или изменения уже существующего материала. Он особенно удобен при изучении электроактивных материалов, используемых в первичных и вторичных источниках тока. [21]
По мнению Туромшиной и Стендера [208], электрохимическое образование интерметаллического соединения имеет место при катодном осаждении цинка. [22]
Оксидные покрытия получаются в результате химического или электрохимического образования слоя окислов на поверхности металла. Эти пленки, как правило, толще естественных окисных пленок; их можно окрашивать или покрывать лаком. Таким способом защищают от коррозии сталь, алюминий и другие металлы - магний, медь и ее сплавы. [23]
Оксидные покрытия получаются в результате химического или электрохимического образования слоя оксидов на поверхности металла. Эти пленки, как правило, толще естественных оксидных пленок, их можно окрашивать или покрывать лаком для повышения защитных свойств. [24]
Оксидные ( окионне) покрытия получаются в результате химического иди электрохимического образования слоя окислов не поверх ности металла. Эти пленки, как правило, толще естественных окисных пленок, их можно окрашивать или покрывать лаком для повышения защитных свойств. [25]
Известно около тысячи работ, включая патенты, относящихся к исследованию электрохимического образования металлических сплавов. Описано около 200 двойных и около 100 тройных электролитических сплавов. [26]
Таким образом, гипотеза о высших пассивирующих окислах железа оказывается неоправданной, а химическое или электрохимическое образование на его поверхности пленки окисла типа РезО4 представляется бесспорно одним из реально возможных путей пассивирования железа в электролите. [27]
В растворе соль может оказаться, например, в результате химического взаимодействия двух компонентов раствора или в результате электрохимического образования на поверхности металла малорастворимой его соли, которая в первый момент переходит в раствор в пересыщенном состоянии благодаря избыточной энергии перенапряжения процесса; затем эта соль выпадает в осадок. [28]
Образование оксидного слоя на алюминии при формовке в электролитах, растворяющих окись алюминия, является результатом двух противоположно направленных процессов: анодного электрохимического образования оксидного слоя и химического растворения слоя в электролите. [29]
Так как анодное растворение никеля сопровождается большой поляризацией, то уже при малой плотности тока ( рис. 105, участок АБ) наблюдается электрохимическое образование закиси никеля NiO. Адатомы никеля, участвующие в образовании окисной пленки, не теряя связи с кристаллической решеткой металла, обусловливают тем самым прочное сцепление фазовой пленки с металлом и со - гt Б здают надежную изоляцию его от электролита. Из-за трудности встречной диффузии ионов металла и кислорода в пленке происходит дальнейшее самоторможение образования пленки, толщина ее достигает лишь нескольких молекулярных слоев. Образовавшаяся окисная пленка обладает некоторой устойчивостью и после устране - ( ния причин, вызвавших ее появление. Это отчетливо наблюдается при снятии поляризационной кривой в обратном направлении. [30]
Страницы: 1 2 3