Бикарбонат - кальций
Cтраница 2
Бикарбонаты кальция и магния обладают значительно более высокой растворимостью, чем карбонаты этих металлов. Но бикарбонаты могут существовать в воде только при наличии в ней растворенной свободной углекислоты, количество которой зависит от давления углекислоты над поверхностью воды и от температуры воды. Повышение температуры воды приводит к уменьшению количества свободной растворенной углекислоты, в результате чего бикарбонаты распадаются на карбонаты с выделением свободной углекислоты. Образовавшиеся карбонаты выпадают из воды в виде накипи. [16]
Бикарбонат кальция Са ( НСОз) 2 - самый дешевый катодный экранирующий ингибитор, применяемый для защиты стали в системах водоснабжения. Бикарбонат кальция в подщелоченной среде образует нерастворимые соединения СаСОз, осаждающиеся на поверхности, изолируя ее от электролита. [17]
Бикарбонат кальция Са ( НСО3Ь - Катодный ингибитор коррозии, содержащийся в природной воде в виде солей карбонатной жесткости. [18]
Бикарбонат кальция Са ( НСОз) 2 - самый дешевый катодный экранирующий ингибитор, применяемый для защиты стали в системах водоснабжения. Бикарбонат кальция в подщелоченной среде образует нерастворимые соединения СаСОз, осаждающиеся на поверхности, изолируя ее от электролита. [19]
Распад бикарбонатов кальция и магния в воде может быть предотвращен введением в нее необходимого количества углекислоты. Это достигается обычно под-кислением охлаждающей воды серной кислотой или ре-карбонацией дымовыми газами от котлов. [20]
Распад бикарбонатов кальция и магния в воде может быть предотвращен введением в нее необходимого количества углекислоты. Это достигается введением в воду 10 - 15 % - го раствора серной кислоты либо рекарбонизацией воды дымовыми газами от котлов. [21]
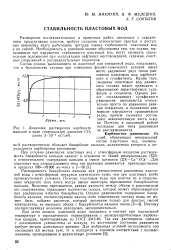 |
Динамика растворения карбоната. [22] |
Растворимость бикарбоната кальция при углекислотном равновесии пластовой воды с атмосферным воздухом значительно ниже, чем при пластовых ( либо промежуточных) условиях. Поэтому пластовые воды при очистке их в сооружениях открытого типа почти всегда имеют некоторое пересыщение бикарбонатом кальция Величина пересыщения, равная разности между общим и равновесным его содержанием, показывает количество осадка, которое может образовываться при разложении избытка бикарбоната. Поэтому соответствующая величина находилась экспериментально. [23]
Так, бикарбонат кальция в подщелоченной среде ( у катодных участков корродирующей поверхности металлов) дает нерастворимые соединения СаСО3, осаждающиеся и изолирующие часть поверхности от действия электролита. Этим, в частности, объясняется меньшая скорость коррозии стали в жесткой воде по сравнению с дистиллированной водой. [24]
При этом бикарбонаты кальция и магния переходят в СаСО3 и Mg ( OH) 2 и выделяются в виде твердой фазы. Сульфат магния при соединении с известью переходит в Mg ( OH) 2 с выделением последней в осадок, одновременно при этом образуется сульфат кальция. [25]
Для образования бикарбоната кальция и невыпадения кальцита из раствора необходимо некоторое количество свободной двуокиси углерода в воде. [26]
Для образования бикарбоната кальция и предотвращения выпадения кальцита из раствора необходимо некоторое количество свободного диоксида углерода. Таким образом, снижение давления в системе газ-вода, приводящее к соответствующему снижению парциального давления СО2, может быть одной из причин уменьшения растворимости кальцита и выпадения его из раствора. Именно этот фактор часто вызывает отложение кальцита на стенках НКТ добывающих скважин выше глубины начала разгази-рования нефти или выше точки ввода газа в газлифтных скважинах. [27]
Образующийся при этом бикарбонат кальция лучше растворяется в воде, чем карбонат кальция. [28]
Под влиянием нагрева бикарбонат кальция образует нерастворимый карбонат, осаждающийся в виде накипи на стенках труб и оборудования. [29]
Образуются каолинит и бикарбонат кальция - хорошо растворяющаяся в воде соль. [30]
Страницы: 1 2 3 4