Бикарбонат-ионы
Cтраница 2
Обычно встречающиеся виды природных вод, кроме небольшого количества свободной СО2 атмосферного происхождения, содержат в основном только бикарбонат-ионы, находящиеся в равновесии с эквивалентным количеством ионов кальция и магния. Содержание свободной СО2 значительно колеблется под влиянием среды. Оно убывает вследствие интенсивно протекающего фотосинтеза и возрастает за счет биохимического разложения органических веществ, а избыточные количества исчезают при соприкосновении воды с атмосферой. В глубинных и минеральных водах концентрации свободной и гидрокарбонатной СО2 достигают исключительно высоких значений, причем в этих водах встречаются также и углекислые соли щелочных металлов. В загрязненных сточных водах равновесие форм СО2 обычно не соблюдается. В некоторых видах этих вод карбонаты, гидрокарбонаты и растворенная СО2 присутствуют в значительных количествах, как загрязняющие вещества. [16]
 |
Зависимость содержания отдельных форм СО2 от рН ( при 25 С. [17] |
Обычно встречающиеся виды природных вод, кроме небольшого количества свободной СО2 атмосферного происхождения, содержат в большинстве случаев только бикарбонат-ионы, находящиеся в равновесии с эквивалентным количеством ионов кальция и магния. Содержание свободной СО2 значительно колеблется под влиянием среды. Оно убывает вследствие интенсивно протекающего фотосинтеза и возрастает за счет биохимического разложения органических веществ, а избыточные количества исчезают при соприкосновении воды с атмосферой. В глубинных и минеральных водах концентрации свободной и гидрокарбонатной СО2 достигают исключительно высоких значений, причем в этих водах встречаются также и углекислые соли щелочных металлов. В загрязненных сточных водах равновесие форм СО2 обычно не соблюдается. В некоторых видах этих вод карбонаты, гидрокарбонаты и растворенная СО2 присутствуют в значительных количествах, как загрязняющие вещества. [18]
Присутствие в питательной воде карбонатов и бикарбонатов натрия является источником образования в котловой воде гидроокиси натрия. Бикарбонат-ионы, поступающие в котел, гидролизуются полностью, а карбонат-ионы - в большей или меньшей степени в зависимости от рабочего давления. В продуктах гидролиза тринатрийфосфата ( г4а3РОд), подаваемого непосредственно в барабаны котлов, также имеется гидроокись натрия. Кремнекислый натрий в котловой воде обычно рассматривают как полностью гидролизованный, даже в условиях котлов среднего давления. [19]
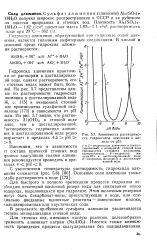 |
Зависимость растворимости гидроксидов алюминия и железа от рН. [20] |
Для быстрого и полного протекания процесса гидролиза необходим некоторый щелочной резерв воды для связывания ионов зодорода, выделяющихся при гидролизе. Этим щелочным резервом могут быть бикарбонат-ионы, присутствующие в воде, или спе-диально введенные щелочные реагенты - известковое молоко, кальцинированная или каустическая сода. [21]
Для второй точки эквивалентности следует рассматривать бикарбонат-ионы ( основание) и избыток соляной кислоты. [22]
При так называемом процессе недосыщения получают умягченную воду с низкой щелочностью, но содержащую некоторые соли натрия. Еще один способ регулирования щелочности состоит в использовании анионообменной смолы, которая замещает содержащиеся в воде бикарбонат-ионы ионами хлора. Этот процесс не дает умягчения, и его обычно применяют в сочетании с Na-катионированием. Если исходная вода не содержит бикарбоната натрия, умягченная вода, предназначенная для питания паровых котлов, после всех процессов ( за исключением параллельного Н - Na-катионирования) требует дополнительной обработки щелочью. [23]
Донные отложения содовых озер заключают карбонаты натрия. Для определения карбонат - и бикарбонат-ионов навеску соли подвергают выщелачиванию холодной водой, отделяют нерастворимый остаток и в водной вытяжке определяют карбонат-и бикарбонат-ионы так, как выше описано для рассолов. [24]
В большинстве случаев этот метод дает правильные результаты. Тем не менее следует иметь в виду, что этот метод определения кальция является косвенным; собственно говоря, соляной кислотой титруют бикарбонат-ионы. [25]
Процесс полной деминерализации воды проводят в две ступени: вначале воду пропускают через слой катионита в Н - форме, а затем через слой анионита. Первая ступень представляет водородный цикл, в котором все катионы, присутствующие в воде, обмениваются на ионы водорода, переходящие в воду, бикарбонат-ионы превращаются в угольную кислоту, а хлориды и сульфаты металлов-в соляную и серную кислоты. [26]
Константа диссоциации угольной кислоты первой степени Ki для уравнения (V.26) равна 4 54 - 10 - 7 при 25 DC, а константа диссоциации угольной кислоты второй степени / С2 для уравнения (V.27) равна 5.6 ЫО-11 при 25 С. Поскольку Кг много меньше Ki, то ионы водорода, образующиеся при первой диссоциации угольной кислоты, реагируют с карбонат-ионом, находящимся в воде в результате растворения карбоната кальция, образуя бикарбонат-ионы. Таким образом, предполагается, что растворенный СаСО3 в основном существует в растворе не в виде кальция и карбонат-ионов, а в виде кальция и бикарбонат-ионов. Таким образом, величина рН характеризует условия равновесия между жидкой фазой, с одной стороны, твердой и газообразной - с другой. На этом основаны некоторые методы прогноза осаждения карбоната кальция из его водных растворов. [27]
При таком способе обработки воды фильтры с Na и Н - катионитом работают параллельно. Затем вода, выходящая из этих двух установок и содержащая бикарбонат натрия и кислоту, смешивается. Ионы водорода и бикарбонат-ионы вступают в реакцию, образуя воду и углекислый газ. Соотношение между количествами воды, подаваемой в каждую из установок, а следовательно, щелочность получаемой в конечном итоге смешанной воды определяется требуемой щелочностью питательной воды парового котла. [28]
Изучение влияния анионного и катионного состава минеральных примесей воды на процесс растворения алюминиевого анода и выход алюминия по току показало [70], что в присутствии ионов С1 - алюминиевый анод находится в активном состоянии и наряду с электрохимическим растворением алюминия идет процесс его химического растворения. Кроме того, ионы хлора, проявляя себя как специфические депассиваторы, препятствуют образованию кислородного барьера и не пассивируют анод в связи с высокой растворимостью хлорида алюминия. Сульфат - и особенно бикарбонат-ионы в некоторой степени тормозят процесс анодного растворения алюминия и уменьшают активирующее действие СГ-ионов. Катионный состав минеральных примесей воды на процесс растворения алюминиевого анода значительного влияния не оказывает. [29]
Основная трудность при концентрировании минерализованных вод состоит в преодолении сульфатного барьера: предотвращение отложений сульфата кальция. Сложность вызывает и подбор затравки, которая в кристаллохимическом отношении должна соответствовать выделяющимся отложениям сульфата кальция. В работе [92] получены данные испытаний опытно-промышленной установки для получения поваренной соли из неочищенных рассолов, содержащих CaSO4 и бикарбонат-ионы. Установка состоит из четырех аппаратов с вынесенной зоной испарения и принудительной циркуляцией. [30]
Страницы: 1 2 3