Бильтец
Cтраница 2
Таким образом, высокотемпературные электрические свойства Т1СЖ и ZrC могут быть интерпретированы как полупроводниковые, однако этот вывод нельзя считать окончательным. В ряде теоретических работ показано, что эти материалы должны быть металлами: зона проводимости перекрывает. Тем не менее нам представляется, что полученные в данной работе экспериментальные результаты не находятся в резком противоречии с этими работами. Действительно, согласно работам Бильтца, плотность состояний в области перекрытия зон ( интервал энергий около 3 эв) очень мала. По-видимому, теория не может в этом случае предсказать существование энергетического зазора порядка десятых электрон-вольт или отрицать его существование. [16]
Она опирается на теорию сильных электролитов Дебая - Гюккеля. Последняя же, как показал В. А. Плесков [122], оправдывается для аммиачных растворов одно-одновалентных электролитов, концентрация которых в 10е раз меньше той концентрации солей, которая была в опытах по дейтерообмену. Эти растворы по своему составу мало отличаются от аммиакатов: на моль соли приходилось восемь молей аммиака. Из работ Бильтца [123] и других авторов [124] известно, что теплота образования кристал-ло-аммиакатов и их прочность повышаются при увеличении заряда и уменьшении радиуса катиона, а при одном и том же катионе они растут с повышением радиуса аниона. Параллельно возрастает число молекул, входящих в состав высшего аммиаката, Безусловно, то же самое происходит и в аммиачных растворах солей. В них молекулы аммиака связаны ионами и находятся в упорядоченном состоянии, причем прочность связи зависит от величины заряда и радиуса иона. Естественно, что с увеличением концентрации соли растет энергия активации реакции, в которой участвует растворитель ( дейтерообмен, аммо-нолиз) - чем прочнее связаны молекулы растворителя ионами, тем большей должна быть энергия активации. [17]
Тем не менее здесь следует указать и на некоторые весьма существенные недостатки в этих работах. В экспериментальной части они заключаются в весьма небольшом числе прямых калориметрических определений теплот образования аммиакатов и полном отсутствии данных для наиболее устойчивых и наиболее интересных представителей этой группы комплексных соединений. Мы имеем в виду аммиакаты солей кобальта ( III), хрома ( III), платины ( II и IV) и других платиновых металлов. Существенным недостатком теоретических построений Бильтца и Гримма является то, что авторы учитывают только электростатические факторы, привлекая для объяснения аномалий поляризационные представления. При помощи же последних можно лишь качественно объяснить наблюдаемые отклонения, но невозможно производить количествевные расчеты. Понятие энергии решетки комплексной соли у Бильтца явно неудачно. [18]
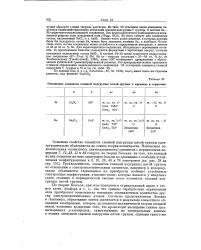 |
Отношение элементов главной подгруппы пятой группы к кремнию и германию. [19] |
Из табл. 98 отчетливо видно изменение характера взаимодействия между металлами главной подгруппы V группы. В системе Sn - Sb существует недальтонидное соединение. Однако часть узлов решетки, в которых должны были бы находиться атомы Sb, может быть замещена атомами Sn, и наоборот. Вследствие этого состав соединения может колебаться в определенном интервале, а именно от 45 до 55 ат. Для характеристики соединения, обладающего переменным составом, по предложению Бильтца, пользуются формулами с черточками вверху, которые указывают идеальный состав SnSb. [20]
Металлы главных подгрупп III и IV групп менее способны к образованию соединений с Аз, Sb и Bi, чем щелочные и щелочноземельные металлы; наоборот, они лучше образуют с ними твердые растворы. Из табл. 98 отчетливо видно изменение характера взаимодействия между металлами главной подгруппы V группы. Sn - Sb существует недальтонидное соединение. Однако часть узлов решетки, в которых должны были бы находиться атомы Sb, может быть замещена атомами Sn, и наоборот. Вследствие этого состав соединения может колебаться в определенном интервале, а именно от 45 до 55 ат. Для характеристики соединения, обладающего переменным составом, по предложению Бильтца, пользуются формулами с черточками вверху, которые указывают идеальный состав SnSb. В системе РЬ - Bi также существует недальтонидное соединение ( 67 - 75 ат. [21]
Простые соли двухвалентного железа, например РеС12 и FeSO4, обладают магнитным моментом около 5 магнетонов Бора. То же имеет место для соединений [ Fe ( OH2) 4 ] Cl2, [ Fe ( NH3) 2 ] Cl2, [ Fe ( NH3) e ] Cl2 и других слабых комплексных солей железа. Напротив, соединения KJFe ( CN) e ] и K3 [ Fe ( CN) 5CO ] имеют момент, практически не отличающийся от нуля. Из этого следует заключить, что в первой группе этих комплексов железо существует в той же форме, что и в простых солях, и что располагающиеся около него группы связаны только вандерваальсовыми силами или за счет поляризационных эффектов. В цианидных комплексах, очевидно, существует другой тип связи. Магнитные измерения подтвердили развивавшееся Бильтцем представление о причине чрезвычайно различной устойчивости двух типов комплексов, а именно нормальных комплексов, в которых в зависимости от рода лигандов существует либо ионная связь, либо связь, обусловленная вандерваальсовыми силами, и комплексов внедрения, существующих благодаря наличию общих для лигандов и центрального атома электронов. Оказалось, что комплекс [ Fe ( CN) eP - следует рассматривать как комплекс внедрения вследствие наличия у него магнитного момента, равного 1 73 магнетона Бора, соответствующего по правилу Льюиса ( см. стр. Экспериментально был обнаружен момент около 2 магнетонов. Следовательно, и в этом случае речь идет о комплексе внедрения. [22]
Страницы: 1 2