Окисел - железо
Cтраница 1
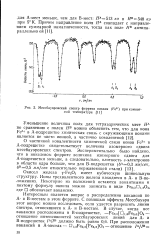 |
Мессбауэровский спектр феррита никеля ( Fe57 прикомнат-лой температуре. [1] |
Окисел железа у - Ре2О3 имеет кубическую шпинельную структуру. Ионы трехвалентного железа находятся в А - и В-по-ложениях. Некоторые из положений остаются вакантными и поэтому формулу окисла можно записать в виде Ре8 / 3П1 / зО4, где П обозначает вакансию. [2]
Окисел железа ( Fe304), получившийся при этом, остается на поверхности металла, а водород улетучивается. Образовавшаяся пленка со временем утолщается и тормозит дальнейшее протекание коррозионного процесса. При отслаивании или растрескивании пленки пароводяная коррозия возобновляется с повышенной скоростью. Этому виду коррозии подвергаются в основном трубки пароперегревателей, но могут подвергаться и кипятильные трубы котлов и экранов, работающие со слабой циркуляцией. Особенно сильной коррозии подвергаются участки стенок котла, у которых происходит образование паровых мешков с местным перегревом металла и глубоким упариванием котловой воды, в результате чего резко возрастает концентрация щелочи в воде, что приводит к возникновению щелочной коррозии. [3]
Какой окисел железа получается при пропускании водяного пара над раскаленным железом. Как называется этот способ получения водорода. [4]
Оба окисла железа являются твердыми примесями в различных силикатных породах. Когда их концентрация становится достаточно большой, порода получает значение железной руды. [5]
Известны три окисла железа. Все они нерастворимы в воде. [6]
Известны четыре окисла железа: FeO-закись, Fe2O: - окись, Fe3O4 - закись-окись и FeOn-железный ангидрид. [7]
Известны четыре окисла железа: FeO - закись, Fe2O3 - окись, Fe3O4 - закись-окись и FeO3 - железный ангидрид. [8]
 |
Результаты анализа питательной воды. [9] |
Оба эти окисла железа встречаются в накипи как в чистом виде, так и в виде твердых растворов. [10]
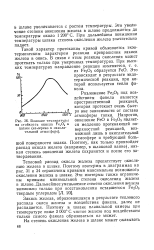 |
Влияние температуры окисление FeO в Ре2Оз являет-на стойкость окисла Fe. O3 в ся медленно протекающей по. [11] |
Тепловой распад окисла железа препятствует окислению железа в шлаке. Поэтому изотермы в диаграммах на рис. 31 и 34 ограничены кривыми максимально возможного окисления железа в шлаке. Эти изотермы также ограничены кривыми минимальной степени окисления железа в шлаке. [12]
Известны четыре окисла железа: FeO-закись, Fe2O3 - окись, Fe3O4 - закись-окись и FeO3 - железный ангидрид. [13]
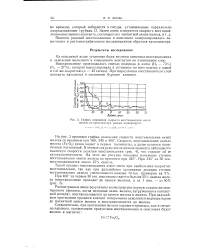 |
График изменения скорости восстановления окиси железа со временем при разных температурах. [14] |
Скорость восстановления окисла железа ( Fe: O3) резко падает в первые полминуты, а далее остается практически постоянной. В первые секунды после начала процесса наблюдается максимум скорости реакции восстановления ( рис. 4), что говорит об ее автокаталитичности. [15]
Страницы: 1 2 3 4