Промежуточный окисел
Cтраница 1
Промежуточный окисел Т14О3 получают, нагревая смесь окиси таллия с закисью, карбонатом или металлическим таллием. [1]
Промежуточный окисел Ti3Os и окись Ti2O3 способны растворять закись железа и ильменит, а также образовывать растворы с ТЮ2 и закисью титана ТЮ. Эти реакции приводят к образованию сложных соединений, кристаллизующихся при затвердевании шлаков. [2]
 |
Растворимость соединений таллия в воде. [3] |
Промежуточный окисел Т14О3 получают, нагревая смесь окиси таллия с закисью, карбонатом - или металлическим таллием. [4]
 |
Зависимость скорости корро. [5] |
С т ( алее следует промежуточный окисел Fe. Соотношение толщин отдельных фаз, а также возможность одновременного образования всех трех окиешш зависит от условии окисления. [6]
 |
Последовательность потенциалов в ( б Е1 2 Е1 3 Е, 3. [7] |
Поэтому окисление закисного железа идет менее энергично и образование активного промежуточного окисла уменьшается. Кроме того, по-видимому, железо в виде высшей активной степени окисления быстрее реагирует с ионом Мп, чем с ионом хлора; образующаяся двуокись марганца, в отличие от хлора, не улетучивается и окисляет остающееся в растворе за-кисное железо. [8]
Поэтому окисление закисного железа идет менее энергично и образование активного промежуточного окисла уменьшается. Кроме того, по-видимому, железо в виде высшей активной степени окисления быстрее реагирует с ионом Мп2, чем с ионом хлора; образующиеся высшие валентные формы марганца, в отличие от хлора, не улетучиваются и окисляют остающееся в растворе закисное железо. [9]
Когда мы добавляем соль Мп 1 1, мы этим уменьшаем инкубационный период; образующийся промежуточный окисел восстанавливается солью Мп и, таким образом, не может уже проявить своего индуцирующего влияния на окисление соляной кислоты. [10]
Молибден образует ряд окислов: МоО3 ( белый с зеленоватым оттенком), MoOj ( темно-коричневый), промежуточный окисел Мо4Оц ( сине-фиолетовый) и некоторые другие. Трехокись молибдена МоО3 ыалорастворима в воде, но растворяется в растворах щелочей и минеральных кислот. [11]
Молибден образует ряд окислов: МоОз ( белый с зеленоватым оттенком), MoOj ( темно-коричневый), промежуточный окисел Mo - iOu ( сине-фиолетовый) и некоторые другие. Трехокись молибдена МоОз малорастворима в воде, но растворяется в растворах щелочей и минеральных кислот. [12]
Им выдвинута гипотеза, основанная на том, что при переходе Fe ( OH) 3 в iF Os образуется промежуточный окисел - уРеО ( ОН) ( лепидокро-кит) ромбической модификации, который изоморфен арагониту ( модификации карбоната кальция) и вследствие этого может играть роль центра кристаллизации карбоната кальция. В водопроводной воде обычно присутствует гидроокись железа Ре ( ОН) з, которая вследствие своей ничтожной растворимости ( ЯР1 Fe ( OH) 3 - 4 - 10 - 38 при 25 С) при значении рН выше 6 5 находится преимущественно в коллоидном состоянии. [13]
 |
Изменение скорости разложения. [14] |
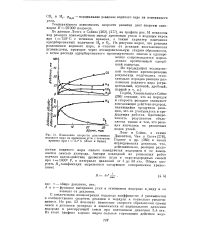
Из рисунка видно, что реакция разложения водяного пара, в отличие от реакции восстановления углекислоты, проходит через последовательную стадию образования, а затем распада адсорбированного промежуточного окисла и одновременно сопровождается параллельно протекающей адсорбцией водорода. [15]
Страницы: 1 2 3