Низший окисел
Cтраница 2
Большинство объемных методов основано на окислении низшего окисла ванадия до пятиокиси. Многие из оксидиметрических методов основаны на окислении ванадия четырехвалентного до пятивалентного. Наиболее распространенным окислителем является перманганат. [16]
При нагревании расплавленного свинца он обращается в низший окисел - глет РЬО, порошок желтого цвета. При электролитическом окислении свинца или при действии на его соли сильными окислителями получается высший окисел свинца - двуокись в виде бурого порошка. [17]
Это объясняется тем, что на пленке низшего окисла железа, образующегося при недостатке кислорода, легче происходит адсорбция или хемо-сорбция добавки, улучшающей маслянистость, чем на пленке высшего окисла железа. [18]
Мерой способности окислов к диссоциации с образованием фазы низшего окисла ( или металла) и кислорода является стандартное изменение свободной энергии Гиббса для соответствующего процесса. [19]
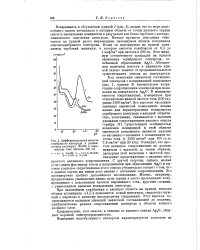 |
Дифференциальная емкость серебряного электрода в разбавленных растворах NaOH в переменном токе частоты 200 гц. [20] |
Следовательно, этот окисел, в отличие от низшего окисла Ag20, обладает хорошей электропроводностью. [21]
Мерой способности окислов к диссоциации с образованием фазы низшего окисла ( или металла) и кислорода является стандартное изменение свободной энергии Гиббса для соответствующего процесса. [22]
Саморазряд первичных серебряно-цинковых элементов происходит вследствие того, что низший окисел серебра AgaO растворяется в щелочном электролите, разрушает материал сепараторов и восстанавливается на цинковом электроде. Сепараторы теряют механическую прочность, в них появляется металлическое серебро, возникают внутренние межэлектродные замыкания. Появление серебра на цинковом электроде приводит к образованию местных коррозионных микроэлементов и газовыделению. Для замедления саморазряда в серебряно-цинковом элементе используют пленочные сепараторы, затрудняющие диффузию ионов серебра к отрицательному электроду. [23]
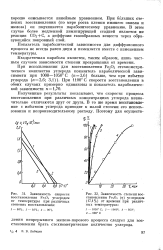 |
Зависимость степени восстановления Fe304 ( T ] углеродом ( 17 1 % от времени при различных температурах. [24] |
При больших степенях восстановления ( по мере роста пленки низшего окисла и железа) он подчиняется параболическому уравнению. В этом случае более медленной лимитирующей стадией является не реакция С02 С, а диффузия газообразных веществ через образующийся покровный слой. [25]
При Е 2 0 - 2 1 В образуются фазовые слои низшего окисла под слоем высшего окисла МеО [6] адс. [26]
Это явление может быть вызвано нарушением структуры решетки и возможным появлением низшего окисла ванадия. [27]
При сжигании углей большая часть германия возгоняется, по-видимому, в виде низшего окисла или сульфида. [28]
Из изложенного должно быть видно, что при описанном механизме равновесный потенциал перехода низшего окисла в высший - это такая же переменная величина, как, скажем, равновесный окислительно-восстановительный потенциал системы Fe2 / Fe3 в растворе. [29]
При Е 2 0 - 4 - 2 1 В образуются фазовые слои низшего окисла под слоем высшего окисла МеО [0] адс. [30]
Страницы: 1 2 3 4