Соответствующий окисел
Cтраница 3
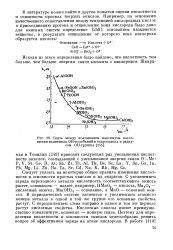 |
Связь между положением максимума поглощения валентных ОН-колебаний в гидроокисях и радиусом ОН-группы. [31] |
Следует указать на некоторые общие правила изменения кислотности и основности простых окислов и их гидратов. С увеличением заряда переходного металла кислотность соответствующего окисла растет, основность - падает, например, НМп04 - кислота, Мп2О7 - кислотный окисел, Мп ( ОН) а - основание, а МпО - основной окисел. [32]
При-гем, если летучесть металла выше летучести соответствующего окисла, линии примеси усиливаются, в противном случае - ослабляются. [33]
Причем, если летучесть металла выше летучести соответствующего окисла, линии примеси усиливаются, в противном случае - ослабляются. [34]
В табл. 13 приведены свойства координационных полимеров 5 5 -мети-лен - бис-салицилового альдегида с медью, никелем, железом и кобальтом. При 350 - 400 С разложение полимеров приводит к количественному образованию соответствующего окисла металла. [35]
Таким образом, поведение окислов щелочноземельных металлов в стекле, за пределами некоторых условно принимаемых пограничных составов, является обратным по отношению к поведению окислов щелочных металлов. Если у первых численные значения nt стремятся к возрастанию при увеличении количества соответствующего окисла в стекле и при уменьшении содержания в стекле кремнезема, то у вторых в таких же условиях они имеют склонность к уменьшению. Это является очевидным следствием того факта, что разность Иг - п у окислов щелочноземельных металлов имеет отрицательный знак, а у окислов щелочных металлов - положительный. Попытка увязать эти явления с теорией строения стекла будет предпринята в дальнейшем. [36]
Было показано, что существует приблизительный параллелизм между каталитической активностью окислов в реакции Н2 с 02 и теплотой образования окиси металла, рассчитанной на 1 г-атом кислорода. Иначе говоря, можно считать, что относительная каталитическая активность связана с относительной восстанавливаемостью соответствующего окисла. Последние сделали допущение об образовании низших окислов и получили обычную вулканообразную кривую, выражающую соотношение между каталитической активностью и энергией взаимодействия промежуточных продуктов реакции с поверхностью. [37]
Отвечающие катионам этой группы гидроокиси весьма сильно различаются по свойствам. Некоторые из них относительно устойчивы, другие, наоборот, настолько непрочны, что распадаются на соответствующий окисел и воду уже в момент образования. Это свойство в наиболее резкой форме выражено у Hg и Hg2, гидроокиси которых практически не существуют; гидроокись серебра легко отщепляет большую часть воды, превращаясь в окись; гидрат окиси меди теряет воду при нагревании. Столь же резко отличаются гидроокиси друг от друга и по своей электролитической характеристике. В качестве крайних случаев могут рассматриваться: сильное основание, AgOH, с одной стороны, и достаточно сильно ионизированная мышьяковая кислота - с другой. Для всех остальных гидроокисей в той или иной мере характерны амфотерные свойства. Наиболее слабо выражена кислотная функция yCd ( OH) 2 и Bi ( OH) 3, которые практически являются только основаниями. Наоборот, соответствующие производные трех - и пятивалентного мышьяка, пятивалентной сурьмы и четырехвалентного олова диссоциируют в растворах преимущественно по кислотному типу. [38]
Отвечающие катионам этой группы гидроокиси весьма сильно различаются по свойствам. Некоторые из них относительно устойчивы, другие, наоборот, настолько непрочны, что распадаются на соответствующий окисел и воду уже в момент образования. Это свойство в наиболее резкой форме выражено у Hg и Hg2, гидроокиси которых практически не существуют; гидроокись серебра легко отщепляет большую часть воды, превращаясь в окись; гидрат окиси меди теряет воду при нагревании. Столь же резко отличаются гидроокиси друг от друга и по своей электролитической характеристике. В качестве крайних случаев могут рассматриваться: сильное основание, AgOH, с одной стороны, и достаточно сильно ионизированная мышьяковая кислота - с другой. Для всех остальных гидроокисей в той или иной мере характерны амфотерные свойства. Наиболее слабо выражена кислотная функция yCd ( OH) 2 и Bi ( OH) 3, которые практически являются только основаниями. Наоборот, соответствующие производные трех - и пятивалентного мышьяка, пятивалентной сурьмы и четырехвалентного олова диссоциируют в растворах преимущественно по кислотному типу. [39]
Если результаты анализа выражены в окисло-ангидрид-ной форме, их следует пересчитать для выражения в ионной форме. Для этого содержание каждого окисла нужно, очевидно, умножить на коэффициент, представляющий собой отношение молекулярного веса данного иона к молекулярному весу соответствующего окисла. [40]
 |
Бинарные катализаторы. [41] |
При классификации окислов по их каталитическим свойствам мы исходили из изложенного выше представления о механизме процесса окислительного дегидрирования. Поскольку олефин, адсорбированный на центре Zlt может подвергаться а - р-изомеризации, мы сочли возможным за меру прочности связи олефина с катализатором принять изомеризующую способность окисла, а за меру прочности связи кислорода была выбрана активность соответствующего окисла в реакции глубокого окисления. [42]
Исходными веществами могут быть пе только галогешщы, но и окислы, если они растворимы в кислотах. Методика работы при использовании окислов по существу не меняется. Соответствующий окисел, например окись сурьмы, растворяют в соляной кислоте и раствор хлорида насыщают хлористым водородом. [43]
Температуры плавления, приведенные в табл. 6, несколько ниже температур плавления чистых окислов, но все же они значительно выше рабочих температур испарителей. Аналогично, максимальные рабочие температуры, указанные в табл. 6, не всегда достижимы в условиях вакуума, так как в этом случае могут возникать дополнительные ограничения. При оценке соответствующего окисла, использующегося в качестве материала испарителя, важным фактором является термодинамическая стабильность. Первые пять окислов, перечисленные в табл. 7, имеют достаточно высокие свободные энергии диссоциации для поддержания пар-циональных давлений кислорода ниже 10 - 12 мм рт. ст. при температуре 2000 С. Окислы ТЮ2 и NiO не могут быть использованы в качестве материалов для испарителей, так как они очень легко разлагаются. Применение SiO2 ограничено, так как она легко отдает кислород некоторым металлам, могущим образовывать окислы с большой термодинамической стабильностью. Так, SiO2 в контакте с А1 или Mg быстро отдает кислород, даже при температуре ниже 1000 С. Другие металлы, такие как Ag, Аи и Pt, не вступают в химическую реакцию, однако температура их испарения близка к температуре размягчения стеклообразного кремнезема или превышает ее. [44]
Для этой цели окисел смешивают с порошкообразным магнием или со стружкой кальция и смесь в стальном или шамотном тигле нагревают до 600 - 800 С. Протекает бурная реакция, в результате которой получается соответствующий окисел и металл. [45]
Страницы: 1 2 3 4