Основной окисел
Cтраница 1
Основной окисел СоО хорошо растворим в кислотах, образует соли двухвалентного кобальта, которые на воздухе не окисляются. [1]
Окисел основной окисел кислотный - - соль. [2]
Замена одного основного окисла другим влияет на энергию связи аниона кислорода со шлаком и на прочность комплексных анионов. Поэтому введение СаО вместо FeO, с одной стороны, должно способствовать сдвигу равновесия, например ( V38), вправо. [3]
Получившаяся СаО ( основной окисел) взаимодействует с SiOa ( кислотный окисел), образуя сель CaSiO3 - силикат кальция. [4]
Трехокись висмута представляет собой основной окисел, произвол - ными которого является большая часть висмутовых солей. [5]
Закись марганца МпО - основной окисел серо-зеленого цвета, пл1785, на воздухе окисляется, при растворении в кислотах образует соли двухвалентного марганца слабо-розовой окраски. [6]
Закись марганца МпО - основной окисел серо-зеленого цвета, tnn 1785, на воздухе окисляется, при растворении в кислотах образует соли двухвалентного марганца слабо-розовой окраски. [7]
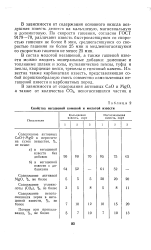 |
Свойства негашеной комовой и молотой извести. [8] |
В зависимости от содержания основного окисла воздушная известь делится на кальциевую, магнезиальную и доломитовую. По скорости гашения, согласно ГОСТ 9179 - 70, различают известь быстрогасящуюся со скоростью гашения не более 8 мин, среднегасящуюся со скоростью гашения не более 25 мин и медленногасящуюся со скоростью гашения не менее 25 мин. [9]
Первый из них-закись хрома СгО - основной окисел. Ему соответствует гидрат Сг ( ОН) 2-слабое основание, образующее соли только с кислотами. [10]
Если данное простое тело образует один основной окисел, то он называется окисью; таковы, напр. Окисями называют также и некоторые безразличные окислы, если они не обладают свойствами перекисей и в то же время не имеют свойств кислотных ангидридов; такова, напр. Если простое тело образует два основных окисла ( или два безразличных окисла, не имеющих кислотного характера), то низшая степень окисления называется закисью; значит, в закиси будет меньше кислорода, чем в окиси. [11]
При этом окись кальция выступает как основной окисел, а двуокись кремния, окись алюминия и даже окись железа ( образующаяся из примесей глины) - как кислотные окислы: получается смесь силикатов, алюминатов и ферритов кальция. Цемент перемалывается и упаковывается для изоляции от воды. [12]
Например, окись натрия Na2O - основной окисел, так как в результате присоединения к нему воды получается основание NaOH - едкий натр. [13]
При использовании закиси никеля в качестве основного окисла для водорода наблюдалась картина, очень близкая к полученной для окисления СО ( рис. 9), хотя диапазон энергий активации ( от 22 ккал / моль для 5 % хрома до 17 ккал / моль для 2 8 % лития) был значительно выше. [14]
Воздушная известь по виду содержащегося в ней основного окисла разделяется на: кальциевую, магнезиальную и доломитовую. [15]
Страницы: 1 2 3 4