Окисление - железо
Cтраница 1
Окисление железа ( II) в железо ( III) может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха, а в кислой среде - азотной и хлорной кислотами и кислородом воздуха. Ионы марганца окисляются различными окислителями, образуя окрашенные анионы различных степеней окисления марганца. Восстановители в кислой среде восстанавливают соединения марганца, хрома, железа и висмута из их высших степеней окисления до соединений низших степеней окисления, В13 - ионы могут восстанавливаться до металлического состояния. [1]
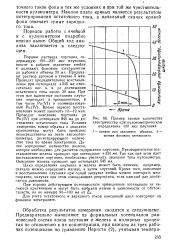
Окисление железа перегретым водяным паром имеет место при температурах выше 450 С. До температуры 500 С скорость пароводяной коррозии невелика, однако с дальнейшим повышением температуры она резко увеличивается. [2]
Окисление железа парами воды подчиняется экспоненциальному закону, описываемому уравнением Аррениуса, в связи с чем лимитирующей стадией процесса восстановления окиси железа является скорость диффузии ионов железа и встречной диффузии ионов кислорода в твердой фазе. [3]
 |
Пример записи количества. [4] |
Окисление железа проводят при потенциале 545 мв. [5]
Окисление железа перед фронтом жидкой окисной пленки также происходит неравномерно. В слое шлака происходит избирательное окисление составляющих железа с внедрением в поверхностный слой кислорода и оттеснением углерода в пленку расплавленного металла на границе раздела между шлаковой фазой и твердым металлом. [6]
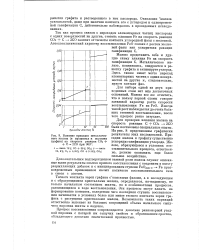 |
Влияние присадок металлического железа ( в процентах к порошку графита па скорость реакции СОз Ч С - 2СО при 960. [7] |
Окисление железа углекислотой, даже при наличии контакта его с углеродом и одновременной газификации С, действительно наблюдалось в проведенных исследованиях. [8]
Окисление железа усложняется образованием трех отдельных слоев окислов железа, доля каждого из которых в общей толщине пленки меняется в зависимости от температуры и парциального давления Оа. Данные, полученные различными исследованиями, отличаются плохой сходимостью, в известной степени это можно объяснить неодинаковой чистотой железа, используемого в разных испытаниях, особенно по содержанию углерода. [9]
 |
Зависи - железобактерий. Последние поглощают из окружаю. [10] |
Окисление железа является, следовательно, актом дыхания железобактерий и заменяет для них протекающее в организмах высших животных окисление углерода. [11]
Окисление железа и марганца и отложение их окислов в чехлах этих бактерий не связано с получением ими энергии. К окислению Fe2 при рН 6 - 8 могут приводить процессы как химической, так и биологической природы. Окисление марганца в этих условиях имеет биологическую природу. Процесс локализован в чехлах, где концентрируются продукты метаболизма и внеклеточные ферменты. У мутантов, лишенных чехлов, накопления окислов железа и марганца не происходило. Таким образом, с помощью восстановленных форм железа и марганца обеспечивается удаление Н202 - токсического продукта клеточного метаболизма. [12]
 |
Микроструктура серого чугуна, термоциклиро-ванного в воздухе ( X 135. [13] |
Окисление железа, кремния, марганца и других компонентов чугуна сопровождается увеличением объема. Поскольку окисление сопряжено с обезуглероживанием, изменение веса чугуна будет определяться развитием этих конкурирующих процессов. Объем чугуна при окислении возрастает и из-за развития диффузионной пористости. [14]
Окисление железа протекает при 1000 С и парциальном давлении кислорода, не превышающем парциального давления диссоциации FeO в 1 бар со временем по линейному закону. Это значит, что скорость определяет реакция на межфазной границе. Это относится и к окислению железа в газовых смесях СО2 - СО. [15]
Страницы: 1 2 3 4