Окисление - двухвалентное железо
Cтраница 1
Окисление двухвалентного железа в трехвалентное ускоряется в присутствии пиролюзита, а также окислов марганца, которыми обрабатывают кварцевый песок и получают так называемый черный песок. Обрабатываемую воду фильтруют сначала через омарганцованный песок ( или; пиролюзит), а затем через обычный песок. [1]
Окисление двухвалентного железа в трехвалентное может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха; в кислой среде-азотной кислотой, бертолотовой солью, кислородом воздуха. [2]
Окисление двухвалентного железа в трехвалентное может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха; в кислой среде-азотной кислотой, хлорной кислотой, кислородом воздуха. [3]
Для окисления двухвалентного железа и нитритов иногда обрабатывают пробу перманганатом. Однако этот метод непригоден при наличии больших количеств органических веществ. [4]
Для окисления двухвалентного железа, а также многих органических примесей применяют хлорирование воды. Введение извести позволяет провести процессы нейтрализации и коагулирования, а также ускорить процесс осаждения гидроокиси железа. [5]
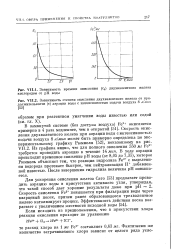
Скорость окисления двухвалентного железа при аэрации воды с интенсивностью подачи воздуха 8 л / мин может быть примерно определена по экспериментальному графику Рюммеля [52], показанному на рис. VII.2. Из графика видно, что для полного окисления 550 мг Fe2 требуется проводить аэрацию в течение 14 мин. В ходе аэрации происходит временное снижение рН воды ( от 8 05 до 7 35), которое Рюммель объясняет тем, что реакция гидролиза Fe2 с выделением водорода протекает быстрее, чем нейтрализация Н добавленной известью. После завершения гидролиза величина рН повышается. [7]
Процесс окисления двухвалентного железа до трехвалентного предполагает наличие кислорода в растворе. Для дозиметрического раствора, насыщенного воздухом, этот предел составляет около 50 000 рад; практически рабочий интервал равен 4000 - 40 000 рад. При насыщении раствора чистым кислородом определяемая доза возрастает в четыре раза. [8]
 |
Зависимость навески и количества НС1 от содержания никеля в образце. [9] |
Аналогично проходит окисление двухвалентного железа. [10]
Произошел процесс окисления двухвалентного железа в трехвалентное под действием азотной кислоты, весьма сильного окислителя. [11]
Поскольку процесс окисления двухвалентного железа в трехвалентное, значительно замедляющийся при рН ниже 7, может вообще не закончиться на очистных сооружениях, удаление СО2 ( последняя образуется в приведенной выше реакции гидролиза в значительном количестве и приводит к снижению рН) является в ряде случаев необходимым этапом обезжелезивания. Если рН воды после гидролиза не падает ниже 7, воздух вводят в воду в таком количестве, которое необходимо лишь для окисления. Это осуществляется введением его во всасывающий патрубок насоса или эжектированием в трубопровод перед фильтрами. [12]
Это объясняется окислением двухвалентного железа в трехвалентное при длительном выветривании ильменита. [13]
Например, для окисления двухвалентного железа, содержащегося в 200 мг FeSO4 - 7H2O, необходимо около 5 8 мг кислорода. [14]
Бром прибавляется для окисления двухвалентного железа и разрушения избытка оксалата аммония, азотная кислота - для окисления сульфид-иона. Окончательная очистка нитрата стронция достигается перекристаллизацией. [15]
Страницы: 1 2 3 4