Окисление - метан
Cтраница 2
Окисление метана и его низших гомологов должно быть рассмотрено отдельно не только из-за резких различий в поведении каждого из них при окислении, но также и потому, что об окислении этих простых углеводородов собрано гораздо больше данных, чем об углеводородах с шестью и большим числом углеродных атомов. В основном данная глава не касается механизма реакций окисления ( см. главу XXXII), и последние будут рассматриваться только в их связи с образованием и деструкцией основных продуктов частичного окисления. [16]
 |
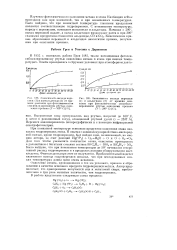
Схема производства формальдегида окислением метана в присутствии. [17] |
Окисление метана в формальдегид в крупном масштабе впервые было осуществлено в Румынии. В основу процесса были положены патенты по применению нитрозных газов в качестве гомо-геннокаталитических добавок. Процесс проводился при 400 - 600 С, с 10-кратной циркуляцией возвратного газа и применением окислов азота ( 1 - 2 %) в качестве гомогенного катализатора. Полезное использование метана составляло 8 % ( считая на свежий метан); около 30 % метана окислялось до СО, СО2 и Н2О; остальное - непревращенный метан. После абсорбции водой получались растворы, содержащие 5 - 7 % формальдегида. [18]
Окисление метана на природном цеолите приводит к образованию формальдегида [253], причем активность катализатора по формальдегиду увеличивается в 4 раза при декатионировании цеолита, т.е. при увеличении его кислотности. [19]
 |
Схема получения формальдегида окислением метана. [20] |
Окисление метана при атмосферном давлении приводит главным образом к образованию формальдегида. При высоком давлении и большом избытке метана в газовой смеси основным продуктом является метиловый спирт. [21]
Окисление метана при высоких температурах осложняется дополнительными реакциями термического распада, диссоциации и взаимодействия свободных радикалов. При изучении кинетики окисления метана возникает необходимость изучения промежуточных стадий процесса, что позволит полностью раскрыть механизм и кинетику взаимодействия метана с кислородом, играющих важную роль при сжигании природного газа в промышленных условиях. [22]
Окисление метана, проводившееся в тех же условиях, привело к образованию в качестве основного продукта гидроперекиси метила. Автор предполагает, что одновременно получается еще и метиловых. [24]
Окисление метана воздухом в присутствии катализаторов дает метиловый спирт СНзОН, формальдегид НСНО, муравьиную кислоту НСООН. [25]
Окисление метана воздухом в присутствии катализаторов дает метиловый спирт СН3ОН, формальдегид НСНО, муравьиную кислоту НСООН. [26]
Окисление метана воздухом в присутствии катализаторов дает метиловый спирт СНзОН, формальдегид НСНО, муравьиную кислоту НСООН. [27]
Окисление метана в формальдегид осуществляют в газовой фазе при атмосферном давлении и температуре порядка 500 С в присутствии различных катализаторов: металлов, их оксидов и солей. Окислителями чаще всего служат воздух и технический кислород. [28]
Окисление метана на природном цеолите приводит к образованию формальдегида [253], причем активность катализатора по формальдегиду увеличивается в 4 раза при декатионировании цеолита, т.е. при увеличении его кислотности. [29]
Окисление метана водяным паром применяют для получения окиси углерода и водорода ( СО Н2) или только окиси углерода. [30]
Страницы: 1 2 3 4