Окисление - нитрит
Cтраница 1
Окисление нитритов в нитраты можно осуществить действием N2O5 [242] и этилгидропероксида; при действии пероксида водорода образуются продукты гидролиза. Алкилнитриты легко восстанавливаются в спирты, хотя в некоторых случаях, возможно, происходит сольволиз, а не восстановление. [1]
Окисление нитрита перманганатом - медленный процесс, непригодный для прямого титрования. Однако при добавлении к раствору нитрита избытка подкисленного перманганата нитрит количественно окисляется до нитрата. Перманганат восстанавливается частично до Мп11, частично до MnIV в виде их окислов. Избыток иодида количественно восстанавливает марганец до Мп11; образующийся иод титруют обычным способом тиосульфатом. [2]
Окисление нитрита натрия в нитрат азотной кислотой проводится в стальном инверторе 10 при температуре 85 - 90, при избытке кислоты в 15 - 20 г / л и непрерывном перемешивании растворов мешалкой и воздухом. [3]
Вследствие окисления нитритов, Н1 ЖЗа - всегда присутствует в растворе, содержащем NOF, В этом случае решающее значение имеет количество. Перед испытанием на NOT важно выяснить, не присутствуют ли какие-нибудь анионы, мешающие данной реакция, в удалить их полностью. [4]
На окисление нитрита натрия до нитрата в сернокислой среде израсходовано 12 64 г перманганата калия. [5]
 |
Пути окисления аммония и нитрита нитрифицирующими бактериями.| Цепь переноса электрона при окислении нитрита у Nitrobacter winogradskyi. [6] |
Исследование окисления Nitrobacter нитрита с использованием в опытах тяжелого изотопа кислорода ( 18О) показало, что образующиеся нитраты содержат значительно больше 18О, когда меченой является вода, а не молекулярный кислород. При этом происходит передача электронов через промежуточные акцепторы на кислород. Весь процесс нитрификации можно представить в виде следующей схемы ( рис. 137), отдельные этапы которой требуют, однако, уточнения. [7]
Чтобы предотвратить окисление нитрита, содержащегося в расплаве, воздух удаляют из межтрубного пространства аппарата через штуцер ( и за-1 ю л н я ют оевобод и в щи и с я объем водяным паром или азотом. [8]
Вторая фаза - окисление нитритов в нитраты осуществляется нитратными бактериями - род. [9]
По окончании процесса окисления нитрита ( что обычно устанавливается анализом) избыточная кислотность нейтрализуется раствором: едкого кали или поташа. [10]
Подробно изучен процесс окисления нитритов - восстановле-лия нитратов, происходящий при участии молибденсодержащих протеинов. [11]
Для ускорения реакции окисления нитрита перманганатом смесь нагревают до 35 - 40 С; реакцию между щавелевой кислотой и перманганатом проводят как обычно при 70 - 80 С. [12]
Выделяющийся свободный кислород вызывает окисление нитритов. Скорость термического разложения нитрат-нитритной смеси зависит от металла, контактирующего с расплавом. [13]
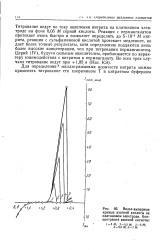 |
Вольт-амперные кривые азотной кислоты на платиновом электроде. Концентрация азотной кислоты. [14] |
Титрование ведут по току окисления нитрита на платиновом электроде на фоне 0 05 М серной кислоты. Реакция с перманганатом протекает очень быстро и позволяет определять до 5 - 10 - 5 М нитрита, реакция с сульфаминовой кислотой протекает медленнее, но дает более точные результаты, хотя, определению поддаются лишь более высокие концентрации, чем при титровании перманганатом. Церий ( IV), будучи сильным окислителем, приближается по характеру взаимодействия с нитритом к перманганату. Во всех трех случаях титрование ведут при 1 05 в ( Нас. [15]
Страницы: 1 2 3 4