Окисление - нитрит
Cтраница 2
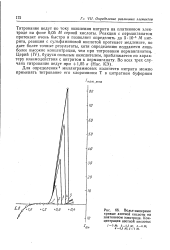 |
Вольт-амперные кривые азотной кислоты на платиновом электроде. Концентрация азотной кислоты. [16] |
Титрование ведут по току окисления нитрита на платиновом электроде на фоне 0 05 М серной кислоты. Реакция с перманганатом протекает очень быстро и позволяет определять до 5 - 10 - 5 М нитрита, реакция с сульфаминовой кислотой протекает медленнее, но дает более точные результаты, хотя определению поддаются лишь более высокие концентрации, чем при титровании перманганатом. Церий ( IV), будучи сильным окислителем, приближается по характеру взаимодействия с нитритом к перманганату. Во всех трех случаях титрование ведут при 1 05 в ( Нас. [17]
Инверсией в данном случае называется окисление нитрита в нитрат натрия азотной кислотой. Одновременно в эту же колонну через переливной бачок 18 из сборника продукционной кислоты 19 центробежным насосом 17 непрерывно подается азотная кислота, а снизу в инверсионную часть колонны по мере необходимости подается острый пар. [18]
При доинвертировании, когда скорость окисления нитрита натрия очень мала, щелока для ускорения реакции нужно нагревать до 100 - 105 при постоянной продувке раствора воздухом. [19]
Несколько более изучена вторая фаза нитрификации - окисление нитрита в нитрат. Были выделены цитохромы, участвующие в этой реакции. Как выяснилось, они связаны с клеточной мембраной, а один из них ( цитохром С) неаутооксидабельный и отличается от цитохрома млекопитающих. Была найдена также цито-хромоксидаза и доказано, что цитохромные фракции бесклеточных экстрактов участвуют в окислении нитрита. Найдена некоторая ДПН-Н2-оксидазная активность и обнаружено слабое фосфорилирование. В экстрактах обнаружена зтерификация 0 5 моль неорганического фосфата на 1 моль окисленного нитрита. [20]
Рассмотрим применение этих законов на конкретном примере окисления нитрита натрия перманганатом калия в кислой среде. [21]
Для того чтобы найти оптимальные условия для реакции окисления нитрита броматом, нами было проведено много опытов, в которых изменялись время реакции и количество кислоты, добавляемой для количественного прохождения реакции. [22]
Энергию для своей жизнедеятельности Nitrobacter получают в результате процесса окисления нитритов. Скорость роста Nitrobacter в значительной степени зависит от концентрации нитритов в среде: отсутствие нитритов подавляет развитие этих бактерий, но содержание нитритов более 0 5 % также вызывает заметную задержку в развитии. [23]
Окисление аммония до нитрита протекает в несколько стадий, а окисление нитрита до нитрата - это одностадийная реакция. [24]
 |
Схема экспериментальной установки. [25] |
Согласно данным [ ai ], механизм процесса состоит в окислении нитрита азотистой кислотой. [26]
Так как перекись водорода в щелочном растворе быстро разлагается, то окисление нитрита до нитрата может быть неполным. Поэтому перевод нитрита в нитрат часто выполняется в кислой среде. Переход нитрита в нитрат происходит не всегда сразу, в некоторых случаях требуется до 15 мин. [27]
Разность потенциалов этой реакции равна 0 58 в, следовательно, окисление нитритов перманганатом должно протекать достаточно энергично. [28]
Хаммер [160] рекомендует воду обрабатывать нитритом натрия и хлораминами для предотвращения окисления нитрита натрия до нитрата. [29]
При определении содержания нитритов методы окислительно-восстановительного титрования могут быть основаны как на окислении нитрита сильноокисляющим агентом, так и на восстановлении его до ряда продуктов в зависимости от природы восстановителя. Правда, восстановление нитрита в аналитической практике используется редко. [30]
Страницы: 1 2 3 4