Окисление - окись - азот
Cтраница 1
Окисление окиси азота протекает по уравнению реакции третьего порядка. [1]
Окисление окиси азота в двуокись не принадлежит к числу реакций, протекающих практически мгновенно. [2]
Окисление окиси азота в двуокись азота ведется в вертикальных железных цилиндрах, выложенных кислотоупорным камнем. [3]
Окисление окиси азота совершается за счет кислорода, находящегося в газовой смеси. Выше 150 С двуокись диссоциирует на окись и кислород, и чем выше температура, тем скорее проходит процесс распада. При 600 двуокись распадается полностью. [4]
Окисление окиси азота протекает по уравнению третьего порядка. [5]
Окисление окиси азота, полученной при окислении аммиака воздухом, проводят в нескольких башнях, орошаемых азотной кислотой такой концентрации, при которой не происходит активного поглощения окислов азота. Циркулирующая в башнях кислота отводит тепло окисления NO, что способствует ускорению реакций образования высших окислов азота. Однако полного окисления NO кислородом воздуха трудно достигнуть вследствие резкого уменьшения скорости реакции по мере понижения концентрации окиси азота. [6]
Окисление окиси азота до двуокиси ( вторая стадия процесса) и абсорбцию - поглощение двуокиси водой ( третья, конечная, стадия процесса) - проводят практически одновременно в одной и той же аппаратуре. Однако закономерности этих процессов целесообразно рассмотреть раздельно. [7]
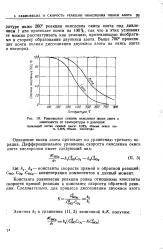 |
Равновесная степень окисления окиси азота в зависимости от температуры и давления. [8] |
Окисление окиси азота протекает по уравнению третьего порядка. [9]
Окисление окиси азота, полученной при окислении аммиака воздухом, проводят в нескольких башнях, орошаемых азотной кислотой такой концентрации, при которой не происходит поглощения значительной части окислов азота. Циркулирующая в башнях кислота отводит тепло окисления NO, что способствует ускорению реакций образования высших окислов азота. Однако полного окисления NO кислородом воздуха трудно достигнуть вследствие резкого уменьшения скорости реакции по мере понижения концентрации окиси азота. [10]
Окисление окиси азота протекает по уравнению третьего порядка. [11]
Окисление окиси азота в двуокись азота используется в нитрозном методе получения серной кислоты и в производстве азотной кислоты. [12]
Окисление окиси азота, полученной окислением аммиака воздухом и имеющей малую концентрацию, проводят в ряде башен, орошаемых кислотой такой концентрации, чтобы при этом не происходило поглощения значительной части окислов азота. Циркулирующая в башнях кислота отводит тепло окисления окиси азота и тем самым способствует ускорению реакций получения высших окислов азота. Однако полного окисления окиси азота кислородом воздуха трудно достигнуть вследствие резкого уменьшения скорости реакции по мере понижения концентрации окиси азота. [13]
Окисление окиси азота до двуокиси является второй стадией процесса получения азотной кислоты. [14]
Окисление окиси азота и взаимодействие двуокиси азота с водой происходят в поглотительной колонне 2, в которую снизу поступают ни-трозные газы из конденсатора, а сверху - вода. [15]
Страницы: 1 2 3 4