Окисление - окись - азот
Cтраница 3
После окисления окиси азота до двуокиси последнюю выделяют из газов циркулирующим слоем силикагеля во второй колонне и концентрированный поток, содержащий 40 - 100 % двуокиси азота, направляют или в обычный абсорбер для получения азотной кислоты, или, если целевым продуктом является сжиженная двуокись азота, на сжатие. [31]
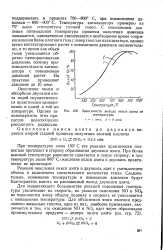 |
Зависимость выхода окиси азота от температуры. [32] |
Реакция окисления окиси азота в двуокись идет с уменьшением объема и выделением значительного количества тепла. Следовательно, понижение температуры и повышение давления будут благоприятно влиять на равновесный выход двуокиси азота. [33]
Реакция окисления окиси азота самая медленная, поэтому она определяет общую скорость процесса переработки нитрозных газов. [34]
Реакция окисления окиси азота протекает медленнее всех других реакций процесса переработки нитрозных газов, поэтому она определяет общую скорость процесса. В связи с этим следует знать время, необходимое для окисления NO в N02 до заданной степени. [35]
Процесс окисления окиси азота катализируется силикагелем. Его ускоряющее действие состоит в том, что на поверхности сили-кагеля происходит концентрирование реагирующих газов за счет их физической адсорбции. [36]
Кинетика окисления окиси азота на активированном угле, Журн. [37]
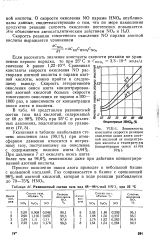 |
Равновесный состав газа над 68 - 98 % - ной HNOj при 25 С. [38] |
Процесс окисления окиси азота проводят в небольшой башне с кольцевой насадкой. [39]
Реакция окисления окиси азота протекает медленнее всех других реакций процесса переработки нитроз-ных газов, поэтому она определяет общую скорость процесса. В связи с этим следует знать время, необходимое для окисления NO и NO2 до заданной степени. [40]
Реакция окисления окиси азота в двуокись азота кислородом не протекает количественно. Степень окисления зависит от соотношения в газе окиси азота и кислорода, времени их взаимодействия и других факторов. Влияние этих факторов на степень окисления NO в NO2 установлено экспериментально в определенных условиях и построены калибровочные кривые, по которым рассчитывают истинное содержание окиси азота в газе. [41]
Реакция окисления окиси азота примечательна тем, что в отличие от подавляющего большинства химических реакций скорость ее с повышением температуры падает. При 0 С реакция протекает в 12 раз, а при 300 С-в 30 раз медленнее, чем при - 130 С. Таким образом, для увеличения скорости превращения NO в NO2 реакционную смесь энергично охлаждают. [42]
Степень окисления окиси азота в двуокись возрастает при повышении давления также вследствие сдвига равновесия в реакциях ( а) и ( б) согласно принципу Ле-Шателье. [43]
Реакция окисления окиси азота обратима, однако при температурах в абсорбере она протекает в одном направлении - в сторону образования двуокиси азота. Это обстоятельство позволяет аналитически проинтегрировать уравнение скорости. [44]
Процесс окисления окиси азота проводят в небольшой башне с кольцевой насадкой. [45]
Страницы: 1 2 3 4