Окисление - оксид
Cтраница 2
Эккертом с сотрудниками огаубликована серия статей [33, 34] по окислению оксида угглерода. В первой из них описаны колебания температурил подложки катализатора и концентрации СО в процессе его окисления чистым кислородом на пористом катализаторе типа СиО на А12О3, осуществляемого в лабюраторном дифференциальном рециркуляционном реакторе. [16]
Представленный на рис. 12 спектр был получен при окислении оксида углерода на никеле. Полосы поглощения при 1390 и 1540 см - соответствуют хемосорбционным комплексам образующегося в ходе реакции СО2 на Ni или NiO. В противоположность полосе при 2200 см - эти полосы наблюдаются и по окончании реакции. Эту структуру можно рассматривать как молекулу СО, адсорбированную на предварительно адсорбированном атоме кислорода, полагая, что реакция протекает по механизму Ридила - Или, согласно которому молекула СО из газовой фазы реагирует с адсорбированным кислородом ( см. разд. [18]
Оксид висмута ( IV) В12О4 получается при окислении оксида висмута ( III) ферроцианидом калия в концентрированном растворе едкого кали или персульфата аммония в разбавленном растворе едкого натра. Соли висмута ( III) легко гидроли-зуются, переходя в основные соли, малорастворимые в воде. [19]
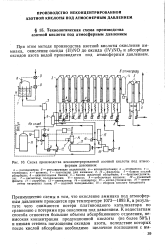 |
Схема производства неконцентрированной азотной кислоты под атмосферным давлением. [20] |
При этом методе производства азотной кислоты окисление аммиака, окисление оксида ( II) NO до оксида ( IV) NO2 и абсорбция оксидов азота водой производятся под атмосферным давлением. [21]
В смеси СО 1 / 2 Og III идет окисление оксида углерода до диоксида по синхронному механизму со скоростями, соизмеримыми для аналогичной реакции в водном растворе. [22]
 |
Газоопределитель оксида углерода ОС-3. [23] |
Принцип действия прибора основан на измерении теплового эффекта реакции окисления оксида углерода до диоксида углерода в присутствии катализатора - гопкалита. [24]
Примером гомогенного катализа в газовой фазе может служить реакция окисления оксида углерода ( II) в присутствии паров воды. [25]
Следовательно, при температуре ниже 3000 С самопроизвольно протекает процесс окисления оксида углерода ( II) кислородом. [26]
Следовательно, при температуре ниже 3000 С самопроизвольно протекает процесс окисления оксида углерода ( II) кислородом. [27]
Механизм реакции для большинства анодных ингибиторов по существу состоит в окислении растворимого оксида двухвалентного железа и образовании защитной пленки из гидроксида железа на поверхности стали. Постепенно из области действия коррозии исключаются новые участки поверхности стали, и процесс коррозии прекращается. Эффективное замедление обеспечивается только при достаточном количестве добавки, отвечающем необходимому для данной системы отношению ингибитор: хлорид. [28]
 |
Кривые отклика концентрации с емкостью и нелинейной равновесной изотермой адсорбции. [29] |
Дробный показатель указывает на наложение механизмов или на то, что окисление оксида углерода несущественно для его конверсии. [30]
Страницы: 1 2 3 4
