Окисление - бромид
Cтраница 1
Окисление бромида проводят, используя горячий щелочной раствор гипохлорита натрия в присутствии буферного раствора ди-гидрофосфата натрия. Избыток гипохлорита разрушают формиа-том натрия и определение заканчивают иодпметрически, используя в качестве катализатора молибдат для ускорения обычно медленной реакции между броматом и иодидом. [1]
Окисление бромида до брома используют в селективном методе [65] определения бромида в присутствии хлорида. [2]
Окисление бромида хлором очевидно идет в три стадии. [3]
После окисления бромида до бромата определение заканчивают фотометрически или йодометрическим титрованием. При фотометрическом методе можно применять метиловый оранжевый или розанилин. В обоих случаях определение основано на выделении свободного брома при добавлении бромида к подкисленному раствору бромата. [4]
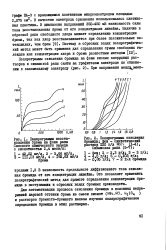
Полярограммы окисления бромида в растворе хлорного железа, снятые на ПЭХ-4, имеют слабо выраженные площадки предельных диффузионных токов ( рис. 5), что обусловлено вращением электрода. Однако при потенциале между электродами 0 5 В зависимость тока от концентрации бромида близка в линейной. [5]
Изучение процесса окисления бромида хлором применительно к ионитной технологии извлечения брома из солевых растворов, Отч. [6]
С увеличением степени окисления бромидов возрастает содержание хлора в бромо-воздушной смеси. Обычно оно составляет 3 - 10 % от количества брома в воздухе. Кроме того, в газе присутствуют BrCl, CO 2, водяной пар, а иногда органические вещества. [7]
Для автоматизации процесса окисления бромида в колоннах непрерывной паровой отгонки брома из смеси кислот ( H6i HCl, H2S04) и растворов бромисто-бромного железа изучено полярографичесвое определение бромида в этих растворах. [9]
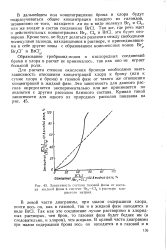 |
Зависимость состава газовой фазы от состава жидкой фазы в системе Вг2 - С12 в растворе хлористого натрия. [10] |
Для расчета степени окисления бромида необходимо знать зависимость отношения концентраций хлора к брому ( или к сумме хлора и брома) в газовой фазе от такого же отношения концентраций в жидкой фазе. Эта зависимость для данного рассола определяется экспериментально или же принимается по аналогии с другим рассолом близкого состава. [11]
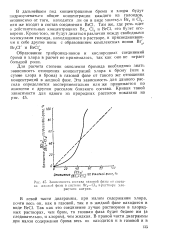 |
Зависимость состава газовой фазы от состава жидкой фазы в системе Br. j - C12 в растворе хлористого натрия. [12] |
Для расчета степени окисления бромида необходимо знать зависимость отношения концентраций хлора к брому ( или к сумме хлора и брома) в газовой фазе от такого же отношения концентраций в жидкой фазе. Эта зависимость для данного рассола определяется экспериментально или же принимается по аналогии с другим рассолом близкого состава. [13]
Напишите уравнения реакций окисления бромида хрома ( III) пероксидом водорода в кислой и щелочной средах. [14]
Метод основан на окислении бромидов и иодидов перманганатом калия в азотнокислом растворе с образованием свободного брома и иода, что позволяет отличить их от хлоридов. [15]
Страницы: 1 2 3 4