Окисление - ртуть
Cтраница 1
 |
Примерная структура потерь ртути в производстве хлора методом с ртутным катодом. [1] |
Окисление ртути в жидких стоках и выделение ее на ионообменных смолах позволяет более полно очищать стоки от ртути. Сульфидная очистка предусматривает окисление ртути, осаждение ее в виде сульфида и фильтрацию. Схема многостадийная и трудна в эксплуатации и регулировании. Наиболее рациональной является организация работы по замкнутой схеме, когда все загрязненные ртутью растворы возвращаются в производственный цикл на покрытие потерь воды в цикле циркулирующего анолита. [2]
Потенциал окисления ртути является пограничным для области анодных потенциалов, в которой можно работать с ртутным электродом. В неводных растворах, так же как и водных, этот потенциал сильно зависит от природы присутствующих в растворе анионов. Таким образом, наиболее широкая область анодных потенциалов, в которой можно работать на ртутном электроде, может быть получена - при использовании перхлоратов в качестве фонового электролита. [3]
 |
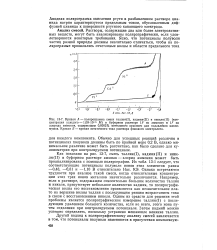
Снижение удельной электропроводности соляной кислоты в зависимости от соотношения кислоты и добавки. [4] |
Процесс окисления ртути проверяли в каскаде аппаратов колонного типа, в которых воздух диспергировался в жидкой фазе - солянокислом растворе СиС12 и распределенной в нем металлической ртути. [5]
При окислении ртути раствором манганата ( VII) калия образуются оксид марганца ( IV) МпСЬ, гидроксид калия и оксид ртути. Для окисления 0 600 г ртути требуется 50 0 см3 раствора манганата ( VII) калия концентрации 0 0200 моль-дм-3. [6]
Во избежание окисления ртути при искрении воздух из баллончика - удаляется вакуумным насосом. [7]
Анодная полярограмма окисления ртути в разбавленном растворе цианида натрия характеризуется предельным током, обусловленным диффузией цианида к поверхности ртутного капающего электрода. [9]
Титрование по току окисления ртути основано на образовании малорастворимого соединения между появляющимися в растворе после точки эквивалентности иодид-ионами и ионами ртути, образующимися при анодной поляризации ртутного капельного электрода. Сила тока обусловлена именно процессом окисления ртути, но величина силы тока пропорциональна содержанию иодида, так как в отсутствии иодида приданном потенциале ( 0 1 в, Нас. КЭ) ртуть еще не окисляется. [10]
Титрование по току окисления ртути основано на образовании малорастворимого соединения между появляющимися в растворе после точки эквивалентности иодид-ионами и ионами ртути, образующимися при анодной поляризации ртутного капельного электрода. Сила тока обусловлена именно процессом окисления ртути, но величина силы тока пропорциональна содержанию иодида, так как в отсутствии иодида при данном потенциале ( 0 1 в, Нас. КЭ) ртуть еще не окисляется. [11]
Процесс получения HgO окислением ртути описан в относящейся приблизительно к 1020 г. книге неизвестного арабского алхимика Ступень мудреца следующим образом: Я взял немного природной чистой ртути и налил ее в стеклянную чашку. [12]
Процесс получения HgO окислением ртути описан в относящейся приблизительно к 1020 г. книге неизвестного арабского алхимика Ступень мудреца следующим образом: Я взял немного природн ой чистой ртути и налил ее в стеклянную чашку. [13]
Последнее означает, что окисление ртути возможно лишь при низких температурах. [14]
Типичной реакцией фотоприсоединения является окисление ртути в процессе облучения смеси паров ртути и кислорода ультрафиолетовым излучением с Я. [15]
Страницы: 1 2 3 4