Окисление - соль
Cтраница 3
Определение основано на окислении солей марганца до марганцевой кислоты персульфатом аммония в присутствии нитрата серебра как катализатора. [31]
Метод основан на окислении солей трехвалентного хрома перманга-натом калия до шестивалентного хрома и определении последнего по реакции с дифенилкарбазидом. [32]
Следует отметить, что окисление декагидродекабо-ратных солей [148, 149] слабыми окислителями, такими, как нитрат железа ( III), сопровождалось появлением интенсивной голубой окраски, подтверждающей присутствие нитрозо - или нитрогрупп. [33]
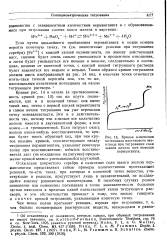 |
Кривая изменения потенциала платинового электрода при титровании соли. [34] |
Осаждение хлористого серебра и окисление соли закиси железа перманганатом представляют собою примеры количественно протекающих реакций, то-есть таких, при которых в конечной точке вещества, участвующие в реакции, присутствуют лишь в незначительной, не поддающейся анализу равновесной концентрации. В подобных случаях резкое повышение или понижение потенциала в точке эквивалентности большею частью находится в пределах одной единственной капли титрующего раствора, и это обстоятельство приводит к тому, что можно говорить о скачке кривой титрования, указывающем конечную точку. [35]
Таким образом, реакция окисления солей Fe в водных растворах является сложной, протекающей в несколько стадий; скорость реакции зависит от концентрации окисляемой соли, анионного состава раствора, температуры, кислотности среды, концентрации кислорода в растворе и различных добавок. [36]
 |
Влияние побочных продуктов на скорость образования моногидро-пероксида - /. дигидропероксида - 2. оксигидроперокеида - 3 при окислении. [37] |
Применение в качестве катализаторов окисления ДИПБ солей металлов переменной валентности приводит к заметному росту скорости реакции окисления при одновременном снижении выхода гидропероксидов. Так, например, окисление п - ДИПБ в присутствии резината марганца протекает лишь до концентрации 25 % ( масс.) гидропероксидов [1, 179], что можно объяснить одновременным ускорением в его присутствии реакций распада гидропероксидов, причем с ростом концентрации гидропероксидов скорость их распада становится выше, чем в отсутствие катализатора. [38]
Таким образом, при окислении солей железа ( II) в окись железа ( III) можно легко освободить раствор сульфата цинка от солей железа, обрабатывая его щелочью. [39]
Поскольку в процессе электролиза происходит окисление солей хрома, для правильной оценки пригодности раствора для электролиза нужно добавить к нему 0 1 г / л гипохлорита натрия и только затем проводить испытания методом амальгамной пробы. [40]
Хотя было установлено, что окисление солей аминогуанидина и карбогидразида происходит таким образом, что каждая группа гидразина окисляется 2 атомами кислорода, например, реагирует с одной молекулой иодата согласно уравнению ( б) и приводит к образованию одной молекулы азота, однако оказалось31, что молекула соли триаминогуанидина, содержащая 3 гидразино-группы, реагирует только с 2 5 молекулами иодата. [41]
Соли окиси железа получаются путем окисления солей двухвалентного железа. Большинство из них хорошо растворимо. В водных растворах они сильно гидролизованы. [42]
Третий изомер был получен при окислении соли Пейроне азотной кислотой. [43]
Полученный раствор гипохлорита натрия применяют для окисления солей железа. [44]
В лабораториях хроматы щелочных металлов получают окислением солей хрома в степени окисления 3 в щелочной среде. [45]
Страницы: 1 2 3 4