Окисление - изопропилового спирт
Cтраница 2
При окислении изопропилового спирта 1 / 0-ым раствором двухромово-кислого калия в присутствии серной кислоты образуется ацетон, который можно открыть в отгоне с помощью метода, предложенного Rae. Осторожно наслаивают 3 мл погона на смесь 2 мл 5 / 0-го раствора нитропруссидного натрия, 2 мл крепкого аммиака и 0 3 г хлористого аммония. Пурпурнокрасное кольцо указывает на присутствие ацетона. [16]
При окислении изопропилового спирта наряду с пероксидом водорода образуется также ацетон. [17]
Инициирование реакции окисления изопропилового спирта действием радиоактивности в литературе не описано и осуществлялось в данной работе впервые. [18]
В процессе окисления изопропилового спирта исследовано инициирующее действие перекисных соединений, ионов тяжелых металлов, газовых инициаторов ( бромистого водорода) и радиоактивности. Из всех исследованных инициаторов наибольшим инициирующим эффектом обладают перекись третичного бутила и перекись водорода. Газовые инициаторы, хотя и ускоряют реакцию окисления, но не пригодны для этой цели из-за нестабильности перекиси водорода в их присутствии. Перспективным методом инициирования является действие у-излу-чения. [19]
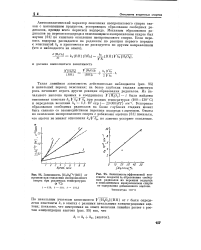
Автокаталитический характер окисления изопропилового спирта связан с накоплением продуктов, ускоряющих образование свободных радикалов, прежде всего перекиси водорода. Механизм образования радикалов из перекиси водорода в окисляющемся изопропиловом спирте был изучен [61] по кинетике окисления изопропилового спирта. [21]
Кинетика процесса окисления изопропилового спирта свидетельствует о наличии в процессе ряда параллельных и последовательных макроскопических стадий и автокаталитическом характере этого процесса. [22]
При инициировании реакции окисления изопропилового спирта в качестве инициаторов были испытаны сернокислые соли кобальта, хрома и марганца. В табл. 3 приведены результаты инициирующего действия этих металлов. Как видно, инициирующее действие ионов металлов, по сравнению с перекисными соединениями и газообразным бромистым водородом, выражено гораздо слабее. Из трех металлов, действие ионов которых здесь изучалось, наилучшими инициирующими свойствами обладают ионы кобальта. [23]
Изучение механизма реакции окисления изопропилового спирта молекулярным кислородом в жидкой фазе предпринималось различными исследователями неоднократно. [24]
Для изучения механизма окисления изопропилового спирта и, в частности, механизма образования перекисных соединений применен известный из литературы [14, 15] метод ингибиторов. [25]
Поскольку в процессе окисления изопропилового спирта в определенных условиях одновременно существуют две формы перекиси - перекись водорода и оксигидроперекись, рассмотрена их роль в процессе вырожденного разветвления. Установлено, что константа скорости распада перекиси водорода примерно в 35 раз меньше таковой для органических гидроперекисей, а скорости вырожденного разветвления, обеспечиваемые той и другой перекисями ( ввиду преобладающей концентрации перекиси водорода) приблизительно одинаковы. [26]
Изучены основные закономерности окисления изопропилового спирта в жидкой фазе молекулярным кислородом. Установлены автокаталитическии характер этой реакции и наличие ряда параллельно и последовательно протекающих макроскопических стадий. Отмечено наличие периода индукции и зависимость его от величины и состояния внутренней поверхности реактора, добавок инги-бирующих и инициирующих веществ и от других факторов. [27]
Изучение механизма реакции окисления изопропилового спирта молекулярным кислородом в жидкой фазе предпринималось различными исследователями неоднократно. [28]
Для изучения механизма окисления изопропилового спирта и, в частности, механизма образования перекисных соединений применен известный из литературы [14, 15] метод ингибиторов. [29]
Поскольку в процессе окисления изопропилового спирта в определенных условиях одновременно существуют две формы перекиси - перекись водорода и оксигидроперекись, рассмотрена их роль в процессе вырожденного разветвления. Установлено, что константа скорости распада перекиси водорода примерно в 35 раз меньше таковой для органических гидроперекисей, а скорости вырожденного разветвления, обеспечиваемые той и другой перекисями ( ввиду преобладающей концентрации перекиси водорода) приблизительно одинаковы. [30]
Страницы: 1 2 3 4