Окисление - сульфид
Cтраница 4
Скорость окисления сульфидов повышается с увеличением давления; оптимальными являются давление 0 3 - 0 4 МПа и температура 90 - 93 С. [47]
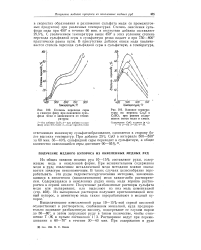 |
Степень перехода серы в газовую фазу при окислении сульфида меди в зависимости от температуры.| Влияние температуры на переход Cu2S в CuSO4 при разном содержании окиси меди в смеси. [48] |
Степень окисления сульфида меди при 450 в течение 60 мин. С увеличением температуры выше 450 в этих условиях степень перехода сульфидной серы в сульфатную резко падает и при 750 - 800 практически равна нулю. [49]
Реакция окисления сульфида молибдена начинается при 360 С для концентрата фракции 0 063 мм; с увеличением размеров частиц молибденита до 0 09 - 0 127 мм температура возгорания возрастает примерно до 500 С. Скорость реакции возрастает с повышением температуры. Однако МоО3 обладает высокой летучестью, увеличиваю-щейся с повышением температуры ( упругость пара МоОз возрастает с 120 Па при 610 С до 1347 Па при 780 С), поэтому принята температура обжига концентрата 650 С. Реакция окисления сопровождается значительным выделением тепла и внешний подогрев, осуществляемый в результате сжигания газа, необходим только на последней стадии обжига ( на восьмиподовой печи газ подают на 7 - й и 8 - й поды), где концентрация сульфида уже невелика. [50]
Реакция окисления сульфида молибдена начинается при 360 С для концентрата фракции 0 063 мм; с увеличением размеров частиц молибденита до 0 09 - 0 127 мм температура возгорания возрастает примерно до 500 С. Скорость реакции возрастает с повышением температуры. Однако МоО3 обладает высокой летучестью, увеличивающейся с повышением температуры ( упругость пара МоОз возрастает с 120 Па при 610 С до 1347 Па при 780 С), поэтому принята температура обжига концентрата 650 С. Реакция окисления сопровождается значительным выделением тепла и внешний подогрев, осуществляемый в результате сжигания газа, необходим только на последней стадии обжига ( на восьмиподовой печи газ подают на 7 - й и 8 - й поды), где концентрация сульфида уже невелика. [51]
Получают окислением сульфида кальция. Белый кристаллический порошок, растворимый в воде. Используется в медицине и для получения других тиосульфатов. [52]
При окислении сульфидов и дисульфидов последовательно образуются сульфоокиси и сульфоны. Идет окисление и углеводородной части с образованием групп ОН, СО, СОО, СООН. После образования сульфонов 4 - 10 % сераорганиче-ских соединений распадается по связи С-S, при этом образуются сульфиновые и сульфоновые кислоты. Дальнейшие термоокислительные превращения некоторых сульфокислот приводят к образованию серной кислоты. Тиофаны превращаются в алифатические серу-и кислородсодержащие соединения. В качестве примера на рис. 50 приведены результаты структурных изменений а-гексилтиофана при окислении. [53]
При окислении сульфида ( например Na2S) отрицательно двухзарядный ион серы превращается в нейтральный атом серы. [54]
При окислении сульфидов сначала образуются сульфоксиды, а затем - сульфоны. Таким образом, сульфоксиды являются промежуточными продуктами реакции. Связь S-О в сульфоксидах сравнительно непрочная, поэтому они обладают рядом специфических свойств и могут служить реакционно-способными исходными веществами в различных процессах. [55]
 |
Данные по окислению персульфатом. [56] |
При окислении сульфида свинца его ион S2 - окисляется до элементарной серы, а сульфатные ионы получаются целиком из персульфата. Этот механизм прямо подтвержден опытом с радиоактивной серой, которая вся переходит из сульфида в элементарную серу, а не сульфат. В отличие от этой реакции, перекись водорода, как было показано выше, окисляет сульфид до сульфата, а не до элементарной серы. [57]
Страницы: 1 2 3 4
