Окисление - таллий
Cтраница 3
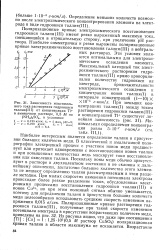 |
Зависимость максимального тока растворения гидроокиси таллия ( Ш от концентрации Т1 в аммиачном растворе, 0 5 М по ( NH4 2SO4, в условиях. [31] |
Наиболее интересным является определение таллия в присутствии больших количеств меди. В классической и амальгамной полярографии электродный процесс с участием ионов меди предшествует или протекает одновременно с восстановлением ионов таллия и при повышенных количествах медь маскирует токи восстановления или окисления таллия. Поскольку ионы меди обычно присутствуют в растворе в двухвалентном состоянии и не склонны к дальнейшему окислению, достаточно большие количества этого элемента не мешают определению таллия рассматриваемым в этом разделе методом. Поляризационные кривые растворения гидроокиси таллия ( III), полученные при такой скорости изменения потенциала электрода в присутствии возрастающих количеств меди, приведены на рис. 32, Из рисунка видно, что даже при соотношении [ Т1 ]: [ Си ] 1: 1 25 - 105 ( 0 5 М раствор CuSO4) поляризационная кривая таллия в области максимума не искажается. [32]
Раствор, содержащий таллий в форме однозарядного иона, должен быть предварительно окислен каким-либо сильным окислителем-перманганатом или персульфатом. Применение хлорной воды в данном случае исключается, так как хлорид-ион образует с таллием ( III) весьма устойчивые комплексные ионы, из которых таллий ( III) бромидом не восстанавливается. Равным образом для окисления таллия ( I) в данном случае исключается применение бромной воды. [33]
Раствор, содержащий таллий в форме однозарядного иона, должен быть предварительно окислен каким-либо сильным окислителем - перманганатом или персульфатом. Применение хлорной воды р данном случае исключается, так как хлорид-ион образует с таллием ( III) весьма устойчивые комплексные ионы, из которых таллий ( III) бромидом не восстанавливается. Равным образом для окисления таллия ( I) в данном случае исключается применение бромной воды. [34]
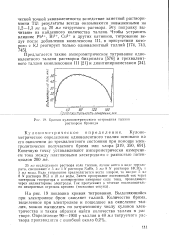 |
Кривая кулонометрического титрования таллия раствором бромида. [35] |
На рис. 19 показана кривая титрования. Выделяющийся при электролизе бром окисляет таллий. Количество брома, выделенное при электролизе и пошедшее на окисление таллия, можно вычислить по затраченному числу кулонов электричества и таким образом найти количество таллия в рас творе. [36]
Таллий представляет собой металл белого цвета с голубовато-серым оттенком. На воздухе он темнеет и становится похожим на свинец. С серой, фосфором и галогенами соединяется непосредственно. В сухом воздухе, кислороде и азоте таллий не окисляется, а лишь тускнеет. При 100 С окисление таллия идет быстро, а в расплавленном состоянии таллий в кислороде сгорает; в воздухе расплавленный таллий дает темные пары. В присутствии влаги таллий окисляется воздухом, поэтому его сохраняют под глицерином или вазелиновым маслом. Таллий при 20 С медленно окисляется на воздухе; с повышением температуры окисление протекает гораздо быстрее. При обычной температуре на воздухе таллий за несколько недель покрывается толстым слоем окиси. Легко растворяется в азотной кислоте; в разбавленной серной кислоте растворение происходит очень медленно, в концентрированной - гораздо быстрее. В соляной кислоте растворение таллия протекает чрезвычайно медленно. [37]
На воздухе темнеет и становится похожим на свинец. С серой, фосфором и галогенами соединяется непосредственно. В сухом воздухе, кислороде и азоте таллий не окисляется, а лишь тускнеет. При 100 С окисление таллия идет быстро, а в расплавленном состоянии таллий в кислороде сгорает; в воздухе расплавленный таллий дает темные пары. В присутствии влаги таллий окисляется воздухом, поэтому его сохраняют под глицерином или вазелиновым маслом. Таллий при 20 С медленно окисляется на воздухе; с повышением температуры окисление протекает гораздо быстрее. При обычной температуре на воздухе таллий за несколько недель покрывается толстым слоем окиси. Легко растворяется в азотной кислоте; в разбавленной серной кислоте растворение происходит очень медленно, в концентрированной - гораздо быстрее. В соляной кислоте растворение таллия протекает чрезвычайно медленно. [38]
Такую обработку повторяют еще 2 - 3 раза. К сухому остатку добавляют 5 мл НС1 ( уд. К раствору добавляют 20 - 50 мг гидрохинона и нагревают в течение часа на водяной бане. Раствор переносят в литровый стакан, добавляют 250 - 300 мл. I раствора, содержащего 6 г га-диметиламинобензола в 97 мл этилового спирта, и 3 мл концентрированной НС1 и затем медленно по каплям при перемешивании вводят 20 мл насыщенного водного раствора метилоранжа. К фильтрату для окисления таллия добавляют до желтой окраски раствор, полученный при взбалтывании 30 г белильной извести с 100 мл воды и отфильтрованный. [39]
Страницы: 1 2 3