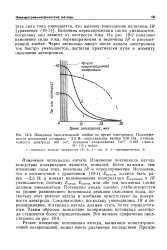
Окисление - вода
Cтраница 2
Значительно шире, чем хлорсодер-жащие реагенты, для окисления сульфидных рточных вод целлюлозных, нефтеперерабатывающих и нефтехимических заводов применяется кис лород. [16]
Потенциалы всех переходов менее положительны, чем потенциал окисления воды ( 1 23 В), и вода не окисляется соединениями серы, но это означает, что все они ( за исключением иона SO) должны окисляться кислородом воздуха. [17]
Другими словами, возбужденные светом молекулы красителя содержат достаточную для окисления воды энергию. В этом случае окисление воды должно осуществиться с вторичным переносом электрона от воды к иону возбужденного красителя. [18]
Необходимо, однако, иметь в виду, что для окисления воды требуется система с высоким значением окислительного потенциала. [19]
 |
САЛ / - ТИП углеродного обмена. [20] |
Тем самым были получены подтверждения представлений об образовании О2 путем окисления воды. Окончательно это было доказано масс-спектрометрич. [21]
 |
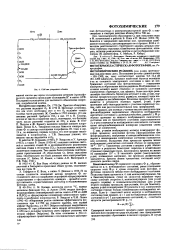
Установка для анализа и-па. [22] |
С; 5 - трубки для поглощения выделяющейся в результате окисления воды; в - кран для переключения движения тока гелия; 7 - деГектор по теплопроводности ( находится при комнатной температуре); - регулятор расхода гелия; 9 - контроль и регулировка подачи гелия в сравнительную ячейку детектора; ю - измеритель расхода гелия. [23]
Ионы водорода для кулонометрического титрования оснований могут быть генерированы благодаря окислению воды у платинового анода. Обычно необходимо изолировать вспомогательный катод, чтобы образующиеся на аноде ионы водорода не подвергались последующему восстановлению. [24]
Потенциал анода, однако, стабилизируется на уровне равновесного потенциала реакции окисления воды, поскольку этот реагент всегда в изобилии присутствует на поверхности электрода. Следовательно, поскольку уменьшились IR и перенапряжение, потенциал катода должен стать более отрицательным. Таким образом, вследствие поляризации потенциал электрода становится более отрицательным. [26]
Растворитель не окисляется на аноде или скорость его окисления ниже скорости окисления воды. В этом случае повышается доля тока, идущая на основной процесс-окисление исходного органического соединения. [27]
Эта реакция вряд ли является подходящей начальной ступенью для восстановления карбоната и окисления воды. Они обнаружили, что газообразная двуокись углерода разлагается на свету с увеличением давления ( вероятно, на окись углерода и кислород), пока не будет достигнуто стационарное состояние. [28]
Часто имеется перенапряжение порядка 0 5 В, по достижении которого скорость окисления воды становится достаточно большой. [29]
Таким образом, суммарный результат фотосинтеза состоит в связывании диоксида углерода, окислении воды до молекулярного кислорода и синтеза углеводов. Образование кислорода как побочного продукта фотосинтеза не является универсальным свойством фотосинтезирующих организмов. [30]
Страницы: 1 2 3 4