Окисление - тиол
Cтраница 1
Окисление тиолов резко отличается от окисления спиртов. В зависимости от природы окислителя продуктами окисления тиолов являются дисульфиды R-S-S-R, сульфиновые RSO2H или сульфоновые RSO3H кислоты. [1]
Окисление тиолов системой Ti1 1 - Н20г или солями CeIV приводит к последовательному возникновению тиильных, сульфиниль-ных и сульфонильных радикалов [64], из которых и образуются конечные продукты реакции. С наибольшей легкостью тиолы окисляются до дисульфидов. В качестве реагентов может быть использован широкий на - - бор реагентов, в том числе кислород ( особенно для щелочных растворов тиолов), иод, о-иодозобензойная кислота, алифатические сульфоксиды, водный раствор тетраацетата свинца с последующей обработкой Ss в бензоле, активированный МпОг, перок-сид водорода и NjO При окислении тетранитрометаном помимо дисульфида образуется также сульфиновая кислота. [2]
Окисление тиолов системой Ti111 - Н О2 или солями CeTV приводит к последовательному возникновению тиильных, сульфиниль-ных и сульфонильных радикалов [64], из которых и образуются конечные продукты реакции. С наибольшей легкостью тиолы окисляются до дисульфидов. При окислении тетранитрометаном помимо дисульфида образуется также сульфиновая кислота. [3]
Окисление тиола установлено также при облучении инсулина. Облучение при рН 3 приводит к образованию геля. Дисульфидные связи также могут быть восстановлены при облучении; подобно тому как цистин и цистамин могут быть восстановлены в тиольную форму ( стр. Однако всегда важно принимать во внимание, что изменения, затрагивающие связи S-S и S - Н - могут быть как следствием денатурации, так и первичными последствиями облучения. [4]
Окисление тиолов отличается от окисления спиртов. [5]
Окисление тиолов резко отличается от окисления спиртов. В зависимости от природы окислителя продуктами окисления ТИОЛОЕ являются дисульфиды R-S-S-R, сульфииовые RSC H или сульфоновые RSOsH кислоты. [6]
 |
Скорость окисления бутантиола-1 воздухом в присутствии метилата натрия в различных растворителях. [7] |
Легкость окисления тиолов зависит от степени их диссоциации. [8]
При окислении тиола ( 158; R СОгМе) получается макроциклический тетрамер. [9]
При окислении тиолов в присутствии оснований большое значение имеет их кислотность. У алифатических меркаптанов кислотность падает с ростом молекулярного веса и разветвленное углеводородного радикала. [10]
При окислении тиолов в первую очередь образуются дисульфиды ( с участием двух молекул тиола), которые в дальнейшем окисляются до сульфокислот. Ниже будут рассмотрены главным образом реакции окисления тиолов в дисульфиды воздухом, без учета дальнейших окислительных превращений дисульфидов. [11]
При окислении тиолов хромовой или ванадиевой кислотами образуются дисульфиды, которые могут подвергаться и дальнейшему окислению. Окисление тиолов в дисульфиды окислами металлов еще мало изучено. Интересно, что эта реакция не зависит от строения тиолов и их кислотности; амины не оказывают на нее каталитического действия. Интенсивное перемешивание, естественно, приводит к увеличению скорости реакции. Лимитирующей стадией этой реакции является адсорбция тиола на поверхности окислов, в результате чего происходит образование тиильного радикала, способного к дальнейшим превращениям. В присутствии олефинов тиильный радикал вступает во взаимодействие с ними по цепному механизму, придавая реакции в целом характер радикального присоединения. [12]
При жестком окислении тиолов ( азотной кислотой) образуются сульфокислоты. [13]
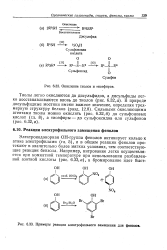 |
Примеры реакции электрофильного замещения для фенолов. [14] |
Сульфон 6.32. Окисление тиолов и тиоэфиров. [15]
Страницы: 1 2 3 4