Окисление - титан
Cтраница 1
Окисление титана сопровождается увеличением его хрупкости. Так, при содержании кислорода 0 3 % он полностью теряет упругие свойства. Титан относится к пассивирующимся металлам. Но пассивация этого металла может происходить не только под действием кислорода. [1]
 |
Условия применения титана в водородных средах при различных температурах. [2] |
Окисление титана раствором при периодическом выключении тока резко снижает катодное наводороживание титана. [3]
Предотвратить окисление титана можно, применяя печи с инертной газовой средой ( заполнение аргоном или гелием) или вакуумные печи. Полуфабрикаты подвергают механической обработке ( например, штамповке), ограничиваясь удалением окалины. Этой цели служит гидропесконструйный или дробеструйный об-дув. [4]
Метод окисления титана повышает износостойкость деталей из титана и его сплавов. [5]
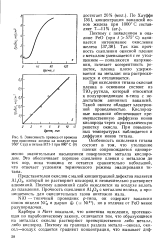 |
Зависимость привеса от времени Диффузия ИОНОВ титана, при окислении железа на воздухе при 950 С ( а и титана ВТ1 - 1 при 880 С. [6] |
Особенность окисления титана состоит в том, что утолщение пленки сопровождается одновременно значительным насыщением поверхности металла кислородом. Это обеспечивает хорошее сцепление пленки с металлом до тех пор, пока толщина ее остается сравнительно небольшой, что отвечает условиям термического режима эмалирования титана. [7]
Скорость окисления титана в определенном интервале температур подчиняется параболическому закону. Помимо окисления титана с поверхности, происходит также диффузия в толщу металла кислорода, образующего твердый раствор с титаном, в результате чего резко повышаются твердость и хрупкость металла. [8]
Процесс окисления титана протекает в три стадии ( рис. IV. Первая стадия окисления, соответствующая области А, состоит в образовании плотной окалины. Окисление при этих температурах определяется параболической зависимостью скорости поглощения от времени. Окисная пленка постепенно достигает такой толщины, что напряжения, возникающие из-за изменения объема металла при окислении, разрывают пленку, в ней возникают трещины и поры. [9]
Процесс окисления титана чрезвычайно сложен. Характерный отпечаток на окисление титана накладывают наличие полиморфного превращения и большая растворимость кислорода в нем. [10]
При окислении титана в парах воды ( рис. 2, а - д и 3, а - г) рост кристаллов, составляющих окалину, происходит иначе. При окислении в парах воды в этот период кристаллы окалины похожи на чешуйчатую черепицу; одинаковая ориентировка окисных кристаллов сохраняется в пределах определенной области; на рис. 2, б виден стык областей, или колоний одинаково ориентированных кристаллов рутила. [11]
При окислении титана в парах воды при температуре 800 - 1200 С окисная пленка состоит только из фазы ТЮ2 в модификации рутила; фаз Ti2O3 и TiO не обнаруживается. Таким образом, основная роль при образовании поверхностных пленок на титане отводится кислороду и водяному пару. [12]
При окислении титана окисная пленка в основном состоит из ТЮ2 - рутила, который относится к полупроводникам / г-типа с недостатком анионных вакансий. Такой окисел обладает электронной проводимостью. Кислородные вакансии обеспечивают преимущественную диффузию ионов кислорода через кристаллическую решетку окисла. [13]
При окислении титана в кипящей 65 % - ной азотной кислоте на его поверхности образуется окисная пленка, состоящая из окисла высшей ступени окисления ТЮ2 со структурой анатаза с небольшим количеством рутила. [14]
При окислении титана протекает и процесс образования нитридов титана. [15]
Страницы: 1 2 3 4