Окисление - титан
Cтраница 3
Метод определения различных степеней окисления титана, предложенный Л. И. Веселаго, основан на использовании окислительно-восстановительных свойств ионов Ti2 и Ti3, которые неустойчивы в кислых растворах и легко переходят в устойчивое четырехвалентное состояние. [31]
Однако стабильность низших степеней окисления титана в галоге-нидах может быть повышена за счет комплексообразования. [32]
В парах воды скорость окисления титана значительно возрастает. В этих условиях, по мнению авторов [8], протекает реакция Ti H2O - - ТЮ2 TiH. Поглощение водорода, приводящее к увеличению объема металла, вызывает растрескивание окалины, что приводит к увеличению скорости окисления. В работе [9] повышенная окисляемость в парах воды объясняется структурными особенностями окалины, которая имеет искаженную структуру рутила, что было обнаружено с помощью методов рентгеновского анализа. [33]
Анализируя приведенные данные по окислению титана, можно сделать заключение о том, что титан не является жаро-стойким металлом, так как скорость его окисления, особенно при высоких температурах, довольно высока. Объясняется это слабыми защитными свойствами окалины. При высоких температурах ( 700 - 1000 С) окалина на поверхности титана пориста л даже склонна к отслаиванию. [34]
Определение титана основано на окислении титана перекисью водорода до надтитановой кислоты, обладающей желтой окраской. [35]
Видно, что при окислении титана по мере повышения температуры наблюдается переход от логарифмического к кубическому, далее к параболическому и через линейный снова к параболическому законам окисления. Изменение законов окисления наблюдается не только при изменении тимперат. Так, при длительном окислении логарифмический закон переходит в кубический, кубический в параболический, а последний в линейный. По данным работы [65], в которой исследование кинетики окисления проводилось путем измерения толщины окисной пленки оптическим методом, действенность логарифмического закона ограничивается температурой 150 С. [36]
Таким образом, при окислении титана водяным паром водород, по-видимому, диффундирует в титан с образованием твердого раствора, из которого при охлаждении образца выделяется гидрид титана. [37]
Освободившийся кислород частично расходуется на окисление титана, отчасти диффундирует в металл, образуя газонасыщенный слой с повышенной твердостью. Восстановленные металлы образуют сложные соединения - силициды и другие интер-металлиды, а окислы титана растворяются в стекле, что подтверждается химическим, спектральным, рентгенофазовым, локальным, рентгеноспектральным, металлографическим методами анализа. [38]
 |
Скорость диффузии кислорода в титане и цирконии. [39] |
Выше 700 С параболический закон окисления титана сохраняется только на протяжении начального периода реакции, а далее сменяется линейным. [40]
Как уже отмечалось, скорость окисления титана при температурах 600 - 700 С почти наверное определяется скоростью диффузии анионных вакансий в двуокиси этого металла, поскольку двуокись титана является проводником - типа. Легирование титана металлами высшей и низшей валентностей должно приводить равным же образом соответственно к замедлению или ускорению окисления этого металла. В этих двух случаях влияние добавок соответствовало тому, что предсказывает теория. [41]
Окисные слои, полученные при окислении титана в парах воды, при том же характере изменения дифракционных картин имели некоторые особенности. [43]
Как уже упоминалось, определяющей стадией окисления титана на воздухе при температурах до 1000 является диффузия кислорода в титан. В присутствии паров воды, так же как и в присутствии СО и СО2 в газовой фазе, скорость окисления заметно растет. [44]
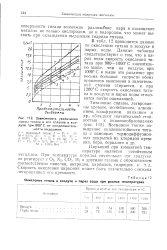 |
Окисление гитана в воздухе м парах воды при разных температурах. [45] |
Страницы: 1 2 3 4