Окисление - углеводород
Cтраница 3
Окисление углеводородов начинается при температурах более низких, чем их температура самовоспламенения. Наиболее устойчивым к окислению по сравнению с другими предельными углеводородами является метан. [31]
Окисление углеводородов, спиртов, альдегидов и кетонов. [32]
Окисление углеводородов представляет собой цепной вырожденно-разветв-ленйый процесс. Оно наиболее трудно потому, что представляет собой либо термический распад валентно-насыщенной молекулы, либо взаимодействие двух валентно-насыщенных молекул. Остальные же звенья цепи неминуемо осуществляются с участием свободных радикалов, что значительно снижает их энергию активации по сравнению с молекулярными реакциями. [33]
Окисление углеводородов кислородом воздуха при использовании растворимых солей переходных металлов продолжает оставаться важным методом синетеза органических кислот. [34]
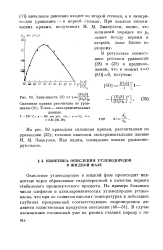 |
Зависимость SO от т ги 0 ]. [35] |
Окисление углеводородов в жидкой фазе происходит полностью через образование гидроперекисей в качестве первого стабильного промежуточного продукта. [36]
Окисление углеводородов сопровождается слабой хеми люминесценцией, которая возникает в результате реакции между двумя вторичными перокеидньши радикалами. Интенсивность хемилюминесценции / 2й4т ] [ RO2 - ] 2, где t ] - квантовый выход свечения в этой реакции. [37]
Окисление углеводородов протекает с большей энергией активации. [38]
Окисление углеводородов, спиртов, альдегидов и кетонов. [39]
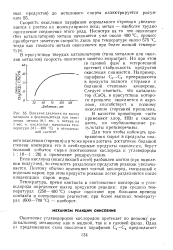 |
Влияние давления на выход метанола и формальдегида при окислении метана ( 8 1 вес. ч. метана на 1 вес. ч. кислорода. начальная температура 341 - 400 С в неподвижной системе. [40] |
Окисление углеводородов кислородом протекает по цепному радикальному механизму как в жидкой, так и в газовой фазах. [41]
Окисление углеводородов происходит, как правило, через последовательность цепных реакций образования промежуточных свободных радикалов и активных центров; при этом реакции могут иметь различный порядок. Обычно цепная реакция начинается с образования одного или нескольких свободных радикалов в результате активного соударения двух стабильных молекул. Эти радикалы, или активные центры, впоследствии вступают в реакцию с другими молекулами с образованием новых радикалов и активных компонентов. Реакция является неразветвленной в том случае, если вместо одного активного радикала образуется один новый. Если вместо одного радикала образуются два или более новых, реакция является разветвленной. Наконец, если в результате реакции радикал превращается в стабильную молекулу, происходит обрыв цепной реакции. Посредством сложных цепных реакций, включающих различные экзо - и эндотермические реакции, молекулы углеводорода и окислителя постепенно превращаются в конечные продукты с выделением значительного суммарного количества теплоты. [42]
Окисление углеводородов представляет собой неизбежно более сложный процесс чем процесс окисления водорода или окиси углерода, и количественные сведения о нем, понятно, менее полны. Имеются соображения о том что цепи содержат радикалы типа СН3, СН: 0 и СН302 наряду с радикалами II, О, ОНиН02, но число последующих возможностей для реакций становится так велико, что нельзя ясно представить, какие элементарные процессы в данном случае являются существенно важными. Поэтому обычно приходится иметь дело главным образом с общим качественным ходом процессов. Углеводородный эквивалент равен 0 65 эквивалента, соответствующего стехиомстрической реакции с кислородом воздуха. Период индукции отмечен в секундах. [43]
Окисление углеводородов в биохимических ТЭ происходит через дегидрогенизацию углеводородного топлива. [44]
Окисление углеводородов представляет собой сложный процесс. В ходе реакции образуются нестабильные промежуточные соединения, претерпевающие дальнейшие превращения с образованием большого числа продуктов. [45]
Страницы: 1 2 3 4