Окисление - уран
Cтраница 3
Авторы нашли, что ио - ны Си2 и Hg2 ускоряют § окисление урана кислоро - Х: дом, ионы Ag, Fe2 и С1 - - § тормозят эту реакцию, а ионы Mg2, Со2 и Мп2 не оказывают заметного влияния на скорость. На основании этих наблюдений авторы приходят к выводу, что реакция проходит по цепному механизму. [31]
Содержимое котла нагревают и перемешивают барботирова-нием воздуха в течение 16 ч с целью окисления урана и растворения получающегося UO2SO4 - Марганец и часть железа при этом также переходят в раствор. [32]
Ион у рана ( VI) - у ранил иО в растворе получается при окислении урана в низших степенях окисления. [33]
Хорошим растворителем тетрафторида урана является горячий раствор нитрата или хлорида алюминия; в его присутствии происходит окисление урана ( IV) до урана ( VI) и связывание F в комплекс с алюминием. Нагревание UF4 с Н3РО4 приводит к образованию фосфата урана ( IV) и полному удалению Р - - иона. [34]
Мешают железо ( II), молибден и медь, так как эти элементы каталитически ускоряют окисление урана ( IV) кислородом воздуха. [35]
Как показали полученные данные, с ростом концентрации соды независимо от температуры ( табл. 1) наблюдается увеличение степени окисления урана. Повышение температуры от 20 до 70 также благоприятно влияет на окисление, однако дальнейший рост температуры до 80 - 90 снижает степень окисления урана ( е) почти в 2 раза. [36]
Раствор урана ( IV), полученный восстановлением с помощью алюминиевой стружки, с кислотностью 2 - 3 N после пропускания воздуха для окисления урана ( III) до урана ( IV) и последующего пропускания азота для удаления растворенного кислорода смешивают с отмеренным объемом раствора феррицианида калия. Для обеспечения полноты окисления урана ( IV) до урана ( VI) феррицианид калия добавляют с избытком, составляющим не менее 50 % от требующегося количества. К смеси прибавляют 3W раствор едкого натра до перехода красно-коричневой окраски феррицианида урана ( IV) в желтую и отмечают израсходованный объем щелочи. Выдержав в атмосфере азота в течение 15 - 20 мин. Образовавшийся ферроцнанид титруют раствором сульфата церня ( IV) по куплям при энергичном перемешивании до перехода темно-красной окраски, обусловленной образовавшимся ферроцианидом у ранила, в бледно-желтую. [37]
Раствор урана ( IV), полученный восстановлением с помощью алюминиевой стружки, с кислотностью 2 - 3 N после пропускания воздуха для окисления урана ( III) до урана ( IV) и последующего пропускания азота для удаления растворенного кислорода смешивают с отмеренным объемом раствора феррицианида калия. Для обеспечения полноты окисления урана ( IV) до урана ( VI) феррицианид калия добавляют с избытком, составляющим не менее 50 % от требующегося количества. К смеси прибавляют 3W раствор едкого натра до перехода красно-коричневой окраски феррицианида урана ( IV) в желтую и отмечают израсходованный объем щелочи. Выдержав в атмосфере азота в течение 15 - 20 мин. V раствора серной кислоты, чем было добавлено щелочи. Образовавшийся ферроцианид титруют раствором сульфата церия ( IV) по каплям при энергичном перемешивании до перехода темно-красной окраски, обусловленной образовавшимся ферроцианидом ураннла, в бледно-желтую. [38]
Навеску сплава 1 0 г растворяют при нагревании в 20 мл раствора серной кислоты ( 1: 1), прибавляя азотную кислоту для окисления урана и молибдена. Раствор выпаривают до появления паров серной кислоты, охлаждают, переносят в мерную колбу емкостью 50 мл и разбавляют водой до метки. Измеряют оптическую плотность при Я 368 нм для определения концентрации урана. Для определения молибдена переносят 5 0 мл полученного раствора в мерную колбу емкостью 50 мл и далее продолжают, как при построении калибровочного графика. [39]
Дешмукх и Джоши [460] к восстановленному с помощью металлического алюминия раствору урана ( IV) добавляют избыток титрованного раствора феррицианида, раствор подщелачивают для завершения окисления урана ( IV) до урана ( VI), затем снова подкисляют 2N раствором серной кислоты, добавляют иодид калия и выделившийся иод титруют раствором тиосульфата натрия или арсенита натрия, применяя крахмал в качестве индикатора. [40]
При температурах до 450 С механизм коррозии урана в водяном паре близок к механизму коррозии в воде, но при более высоких температурах процесс больше напоминает окисление урана в двуокиси углерода. При температурах выше 450 С гидрид урана неустойчив, и водород выделяется прямо в газовую фазу. При повышении температуры от 500 до 1200 С скорость реакции растет очень медленно. Сообщалось, что при температурах 500 - 1200 С в периоды между 30 мин и 6 ч процесс описывается параболическим законом [22], но в другой работе [21] указывается, что этот закон справедлив лишь в течение 1 - 2 ч в области температур выше 880 С, а во всех остальных случаях окисление происходит по линейному закону. Из этого следует, что в течение первых I-2 ч коррозия урана в водяном паре приближается к коррозии его в двуокиси углерода. При температурах ниже 700 С скорость коррозии в паре больше, чем в двуокиси углерода, а при более высоких температурах она примерно такая же или несколько меньше. [41]
Дешмукх и Джоши [ 4601 к восстановленному с помощью металлического алюминия раствору урана ( IV) добавляют избыток титрованного раствора феррицианида, раствор подщелачивают для завершения окисления урана ( IV) до урана ( VI), затем снова подкисляют 2N раствором серной кислоты, добавляют иодид калия и выделившийся иод титруют раствором тиосульфата натрия или арсенита натрия, применяя крахмал в качестве индикатора. [42]
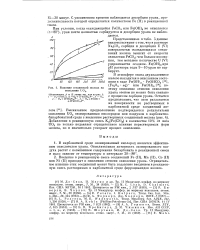 |
Влияние соединений железа на окисление U02. [43] |
Введение в реакционную смесь соединений Fe ( II), Мн ( II), Со ( II) или Ni ( II) приводит к снижению степени окисления урана. Отрицательное влияние этих соединений может быть подавлено введением в реакционную смесь растворимых в карбонатной среде ферроцианидов железа. [44]
В атмосфере озона двухвалентное железо находится в окисленном состоянии в виде Fe ( OH) 3 FeOHC03 [15], ( Fe203 aq) - или Fe ( OH) 3 [ 18, поэтому снижение степени окисления урана озоном не может быть связано с процессом сорбции урана. Добавление в реакционную смесь K3 [ Fe ( CN) 6l в количестве 10 % от веса U02 не только подавляет отрицательное влияние нерастворимых форм железа, но и значительно ускоряет процесс окисления. [45]
Страницы: 1 2 3 4