Окисление - хлорат
Cтраница 1
Окисление хлоратов до перхлоратов можно проводить на анодах из диоксида свинца [49-51], осаждаемого электролитически из растворов его нитрата с различными добавками. При нанесении слоя РЬО2 на титан необходимо принимать меры по предотвращению образования переходного сопротивления между титановой основой и активным слоем вследствие окисления титана в процессе электролиза; при электролитическом нанесении РЬОз на графит необходимо защитить графитовую основу анода от окисления при электролизе. [1]
Окисление хлоратов в перхлораты протекает при высоких положительных потенциалах. [2]
В процессе окисления хлората до перхлората с изменением концентрации хлората изменяются электрохимические показатели электролиза, в частности, снижается выход по току и возрастает удельный износ анодов как платиновых [115, 116], так и из перекиси свинца. Для уменьшения потерь выхода по току и материала анодов процесс обычно проводят в каскаде электролизеров, последовательно включенных по току жидкости. Так же, как и в производстве хлоратов, каскад обычно состоит из четырех-пяти электролизеров. Поскольку электрохимические показатели процесса ухудшаются при v снижении концентрации хлората в электролите ниже 50 г / л на платиновых анодах и ниже 100 г / л на анодах из перекиси свинца, весь процесс окисления разделяют на две стадии: продукционную и завершающую очистную. На первой стадии концентрация хлората натрия выше критической и электрохимические характеристики мало меняются. На завершающей стадии с понижением концентрации хлората натрия снижается выход по току, возрастает доля тока, затрачиваемого на выделение кислорода, и увеличивается удельный расход анодов. [3]
Предложено 213 осуществлять окисление хлората калия до перхлората двуокисью свинца в сернокислой среде. [4]
Предложено 188 осуществлять окисление хлората калия до перхлората двуокисью свинца в сернокислой среде. [5]
 |
Выход по току при различной концентрации ЫаСЮз.| Напряжение на электролизере при различной плотности тока. [6] |
При любом механизме окисления хлората до перхлората получению высоких выходов по току должна способствовать высокая концентрация хлората в электролите. По мере ее снижения выход по току должен уменьшаться, причем особенно сильно после достижения предельной критической концентрации хлората. [7]
 |
Растворимость NaClO4 в воде. [8] |
В пользу указанного механизма свидетельствуют результаты исследования процесса окисления хлоратов до перхлоратов в воде, меченной тяжелым изотопом кислорода 8 О. [9]
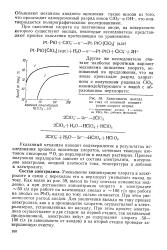 |
Зависимость выхода по току от конечной концентрации хлората натрия. [10] |
Указанный механизм находит подтверждение в результатах исследования процесса окисления хлоратов, меченных тяжелым изотопом кислорода 18 О, до перхлоратов в водных растворах. Процесс получения перхлоратов зависит от состава электролита, материалов электродов, анодной плотности тока, температуры и добавок к электролиту. [11]
 |
Растворимость NaClO4 в воде. [12] |
В пользу указанного механизма свидетельствуют результаты исследования процесса окисления хлоратов до перхлоратов в воде, меченной тяжелым изотопом кислорода 8 О. [13]
Перхлораты могут быть получены химическим путем, например окислением хлората свежеосажденным диоксидом свинца или электрохимическими методами. В промышленной практике приняты электрохимические методы. Они главным образом основаны на окислении на платиновых анодах хлората. Считалось, что прямое злектроокисление хлорида натрия до перхлората нецелесообразно, так как хлорат можно вначале получать электролизом на графитовых анодах, а затем доокислять хлорат до перхлората на платиновых анодах. [14]
 |
Выход по току при различной концентрации NaClOs. [15] |
Страницы: 1 2 3