Окисление - боковая цепь
Cтраница 2
Предложен автоклавный метод окисления боковой цепи гомологов бензола с образованием альдегидной и карбоксильной группы. Так, толуол нагреванием в автоклаве с водой и кислородом до 235 - 240 при 50 - 60 ат в присутствии катализатора ( Ре2Оз Н2О) или без катализатора при более высокой температуре ( 280 - 305) переводится п бензальдегид с небольшой примесью бензойной кислоты. [16]
Предложен автоклавный метод окисления боковой цепи гомологов бензола с образованием альдегидной и карбоксильной группы. Так, толуол нагреванием в автоклаве с водой и кислородом до 235 - 240 при 50 - 60 ат в присутствии катализатора ( Ре2Оз Н2О) или без катализатора при более высокой температуре ( 280 - 305) переводится в бензальдегид с небольшой примесью бензойной кислоты. [17]
Марганцевокислый калий применяют для окисления боковых цепей в ароматических и гетероциклических соединениях до карбоксильной группы. В большинстве случаев карбоновые кислоты менее растворимы в воде, чем их щелочные соли. [18]
Марганцовокислый калий применяют для окисления боковых цепей в ароматических и гетероциклических соединениях до карбоксильной группы. В большинстве случаев карбоновые кислоты менее растворимы в воде, чем их щелочные соли. [19]
Марганцевокислый калий применяют для окисления боковых цепей в ароматических и гетероциклических соединениях до карбоксильной группы. В большинстве случаев карбоновые кислоты менее растворимы в воде, чем их щелочные соли. [20]
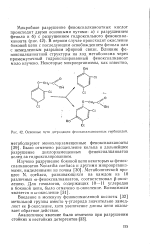 |
Основные пути деградации феноксиалканоатных гербицидов. [21] |
В первом случае происходит окисление боковой цепи с последующим освобождением фенола или с немедленным разрывом эфирной связи. Влияние фе-ноксиалканоатной структуры на ход метаболизма через промежуточный гидроксилированный феноксиалканоат мало изучено. [22]
Более того, легкость окисления боковой цепи может быть объяснена на основании расчетов относительной электронной плотности НСМО на ароматическом атоме углерода, соседнем с метиль-ной группой, по сравнению с другими положениями в катион-радикале. Относительная электронная плотность НСМО в положении, соседнем с метильной группой, в n - метиланизоле выше, чем аналогичная величи-на для jn - метиланизола. Цианид-ион атакует ароматический атом углерода, соседний с метильной группой, так как электронная плотность НСМО на нем наибольшая, и отщепляет протон из бензильного положения катион-радикала. [23]
Метод образования карбоксильной группы путем окисления боковой цепи на практике применяют почти исключительно к ароматическим соединениям с метильной группой. [24]
Последний пример показывает, что окисление боковых цепей до карбоксила хорошо проходит также в присутствии метоксильной группы. В присутствии свободной фенольной группы подобное окисление не удастся, так как при этом разрушается ароматическое ядро или образуются производные хииона. Теперь свободные фенольиые гидроксилы защищают тем или иным образом и ведут окисление марганцовокислым калием ( пример см. ниже), который, так же как и марган-цовистокислый калий, является одним из лучших и наиболее широко применяемых окислителей для превращения боковых цепей в карбоксил, особенно для о-замещеиных соединений. [25]
Это свидетельствует об уменьшении процессов окисления боковой цепи этилбензола. Снижается также образование сажи, что говорит об уменьшении процессов глубокого пиролиза углеводорода. [26]
Природа этой изомерии была выяснена путем окисления боковой цепи хромовой кислотой и исследованием образующихся при этом летучих продуктов. При окислении ацетата кампестерина были выделены ацетон ( разрыв связи между С34 и С25) и с. Следовательно, кампестерин отличается от эргостерина конфигурацией при C2i и относится к ряду 24а - стеринов. Кампестерин не идентичен 22 23-дигидробрассикастерину, полученному через производное, в котором двойная связь в положении 5 6 была защищена1 9 -; указанное наблюдение подтверждает вышеприведенные доводы, согласно которым брассикастерин относится к ряду 24Ь - со-единений. [27]
Как уже было упомянуто выше, окисление боковых цепей, в о-поло-жении к которым находятся негативные заместители, не идет с обычными окислителями. В этих случаях с успехом применяют железосинеродистый калий и марганцовистокислый калий. [28]
Разбавленная азотная кислота широко применяется для окисления боковых цепей ароматических соединений. Недостатком этого способа является то обстоятельство, что продукт реакции обычно содержит заметное количество нитросоединенйй. Разбавленная азотная кислота, содержащая в растворе перманганат, с успехом применялась для окисления тетрагалоидозамещенных ксилолов в соответственные фталевые кислоты. [29]
Разбавленная азотная кислота широко применяется для окисления боковых цепей ароматических соединений. Недостатком этого способа является то обстоятельство, что продукт реакции обычно содержит заметное количество нитросоединенйй. Разбавленная азотная кислота, содержащая в растворе перманганат. [30]
Страницы: 1 2 3 4