Окисление - цинк
Cтраница 1
Окисление цинка ZnZn2 2e - происходит на отрицательном электроде, восстановление меди Си2 2е - Си на положительном. [1]
Окисление цинка Zn Zn2 2e - происходит на отрицательном электроде, восстановление меди Cu2 2e - Cu на положительном. [2]
Окисление цинка Zn Zn2 2er происходит на отрицательном электроде, восстановление меди Си2 2е - Си - на положительном. [3]
Окисление цинка Zn Zn2 2e - происходит на отрицательном электроде, восстановление меди Cu2 2e - Cu на положительном. [4]
Вследствие окисления цинка в шихте в верхних зонах печи в футеровке отлагается оксид цинка. В нижних зонах печи идет восстановление и отложение цинка. В результате повторения этого процесса окисления и восстановления возникает циркуляция цинка в печи и происходит накопление его паров в печных газах. [5]
Скорость окисления цинка почти не зависит от давления О2, так как концентрация промежуточных ионов цинка на границе раздела кислород - оксид очень мала и дальнейшее ее снижение вследствие повышения давления О2 лишь незначительно влияет на градиент концентрации между границей раздела и поверхностью металла, где концентрация Zn2 в междоузлиях наибольшая. [6]
При окислении цинка и кадмия образуется, наоборот, рыхлая толстая пленка окисла; причем с увеличением толщины пленки число трещин на ней растет, и, следовательно, возрастают вероятность столкновения частиц пара с поверхностью металла и скорость сублимации. [7]
При окислении цинка ионы цинка переходят в раствор, а электроны остаются в металле. По проводнику, соединяющему металлы, эти электроны переходят на никель и расходуются в реакции восстановления ионов никеля. Такие процессы протекают до тех пор, пока весь цинк не растворится или не израсходуются частицы, которые могут восстанавливаться на никеле. [8]
Рассмотрим процесс окисления цинка с образованием твердой окиси в результате взаимодействия с кислородом цинка, находящегося в твердом, жидком или газообразном состоянии. [9]
 |
Схема процессов в элементе Даниоля. win - пористая диафрагма. А - анод. К-катод. [10] |
Первое уравнение выражает окисление цинка, второе-восстановление меди. [11]
При этом скорость окисления цинка ( кривая 1) характеризуется отрезком ia а скорость восстановления водорода ( кривая 2 -отрезком гк. [12]
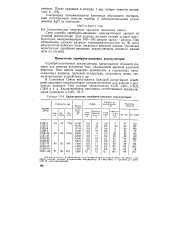 |
Характеристики серебряно-цинковых аккумуляторов. [13] |
На отрицательном электроде проходит окисление цинка. [14]
Как видно, степень окисления цинка повышается от нуля до 2 и равна заряду иона цинка 2 - Вещества, отдающие свои электроны в процессе реакции, называются восстановителями. В данной реакции восстановителем является цинк. В результате реакции степень окисления элемента возрастает. Это значит, что вещество из восстановленной формы превращается в окисленную. [15]
Страницы: 1 2 3 4