Окисление - цистеин
Cтраница 1
Окисление цистеина до цистина протекает по аналогичной схеме. [1]
Окисление цистеина в цистин возможно и неферментативным путем. [2]
При окислении цистеина бромной водой сульфгидрильная группа переходит в сульфогруппу и образуется аминосульфо-кислота - цистеиновая кислота HO3S - СНз - гСН МНг) - СООН. Тау-рин был открыт в продуктах гидролиза бычьей желчи ( от лат. Таурин встречается в мясном экстракте и в некоторых органах низших животных. [3]
При окислении цистеина бромной водой сульфгидрильная группа переходит в сульфогруппу и образуется аминосульфо-кислота - цистеиновая кислота HO3S - СН2 - CH ( NH2) - СООН. Tay-рин был открыт в продуктах гидролиза бычьей желчи ( от лат. Таурин встречается в мясном экстракте и в некоторых органах низших животных. [4]
При окислении цистеина в присутствии формальдегида образуется N-формилцистеин. [5]
Образуется при окислении цистеина кислородом воздуха в щелочных р-рах. [6]
Анодное растворение золота при окислении цистеина незначительно и может быть вызвано ли. [7]
Каталитические свойства фталоцианинов в реакции окисления цистеина / / Кинетика и катализ. [8]
Фосфорсодержащие ионитные комплексы железа способны катализировать окисление цистеина. Следует отметить, что селективность окисления неудовлетворительна, а о стабильности катализатора данных нет. [9]
Первый пик на анодном ходе кривой окисления цистеина в кислых растворах относится к окислению его до цистина, а второй - к окислению цистина до RSSOs - и RCOOH. При более положительных потенциалах наблюдается спад тока, связанный с пассивацией поверхности золота кислородсодержащими частицами. В нейтральной среде цистеин, вероятно, окисляется по тому же механизму, так как форма и кинетические параметры поляризационных кривых в кислых и нейтральных растворах сходны. [10]
Наличие этой аминокислоты в свободном состоянии в моче и тканях объясняется ее образованием в процессе окисления цистеина ( стр. [11]
Гидролиз белков кислотой обычно сопровождается разрушением ( в результате окисления) большей части триптофана, окислением цистеина в цистин и некоторым распадом серина и треонина. Щелочной гидролиз имеет то преимущество перед кислотным, что триптофан в этих условиях более стабилен. Однако при щелочном гидролизе имеет место интенсивный распад серина, треонина, цистина, цистеина и аргинина. Кроме того, при щелочном гидролизе наблюдается рацемизация природных аминокислот. Гидролиз белка как кислотой, так и щелочью сопровождается дезамидированием глутамина и аспарагина. [12]
Значительное затруднение при расшифровке последовательности аминокислот может возникнуть, если в молекуле анализируемого белка присутствуют остатки цистеина или цистина. При окислении цистеина образуются S-S - мостики, которые не только являются причиной ошибочных выводов, но и препятствуют дальнейшему анализу, так как содержащие их белки и полипептиды весьма устойчивы к ферментативному расщеплению. Поэтому до проведения анализа рекомендуется избавляться от S-S - мостиков и предотвращать спонтанное окисление свободных SH-групп. Кроме того, следует иметь в виду возможность SH / S-S - обмена. [13]
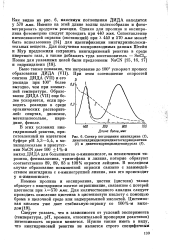 |
Спектр поглощения нингидрина ( 1. [14] |
Помимо пролина и оксипролина, цистин ( цистеин) также образует с нингидрином желтое окрашивание, связанное с потерей цветности при Х570 ммк. Для количественного анализа следует проводить окисление цистеина в цистеиновую кислоту с помощью брома в щелочной среде или надмуравьиной кислотой. [15]
Страницы: 1 2