Окисление - этан
Cтраница 3
Наряду с тем, что интенсивно изучалось окисление этана, в топливных элементах также были окислены водород, метанол и ряд газообразных углеводородов. [31]
Коймап 1116 ] сообщает о получении перекисей окислением этана и пропана кислородом. [32]
Затем Эмануэль совместно с Седовой [85] изучил кинетику окисления этана в присутствии бромистого водорода и объяснил его роль в образовании из этана уксусной кислоты. [33]
Как следует из таблицы, основными промежуточными продуктами окисления этана при высоких давлениях являются этиловый спирт и уксусная кислота. В меньших, но все же значительных количествах накапливаются также метиловый спирт и ацетальдегид. Совсем невелик выход формальдегида и муравьиной кислоты. [34]
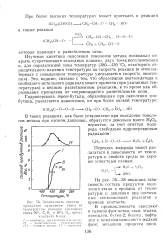 |
Зависимость состава. [35] |
На рис. 56 - 58 показана зависимость состава продуктов окисления этана и пропана от температуры и давления при постоянных соотношениях реагентов и времени контакта. [36]
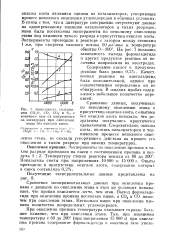 |
Зависимость содержания СНеО, СО, СО2 и О в конечном газе от напряжения на электродах при окислении этана без окислов азота. [37] |
Сравнение экспериментальных данных при окислении пропана с данными по окислению этана в этих же условиях показывает, что пропан окисляется легче, чем этан. [38]
В том же 1954 г. Нокс и Норриш [97] изучили окисление этана с целью выяснить существуют ли у этого углеводорода холодные пламена. Выше уже было сказано ( см. стр. Норриша, периодические холодные пламена углеводородов образуются как результат термической нестабильности реагирующей системы и наличия у нее области с отрицательным температурным коэффициентом скорости окисления. [39]
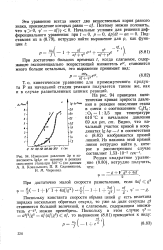 |
Изменение давления Др и зависимость Ig4p от времени в реакции. [40] |
На рис. 94 приведена кинетическая кривая прироста давления в реакции окисления этана в смеси с соотношением С2Не: : О2 1: 3 5 при температуре 610 С и начальном давлении 69 мм рт. ст. Видно, что начальный участок кривой в координатах lg Др - / в соответствии с (8.82) изображается прямой линией. [41]
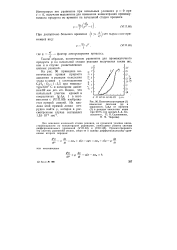 |
Кинетическая кривая ( 1 изменения давления Др и зависимость IgAp от времени ( 2 в реакции окисления этана при 610 С ( по данным А.А. Ковальского, П.Я. Садовникова, Н, М. Чиркова. [42] |
На рис. 96 приведена кинетическая кривая прироста давления в реакции окисления этана в смеси с соотношением С2Н8: О21: 3 5 при температуре 610 С и начальном давлении 69 мм рт. ст. Видно, что начальный участок кривой в координатах lg Ар, t в соответствии с ( VIII. [43]
 |
Зависимость изменения давления Д /. ( / и ig Др ( 2 от времени в реакции окисления этана при 610 С ( по данным Л. А. Коваль ского, П.Я.Садошшкова, Н.М.Чиркова. [44] |
На рис. 108 приведена кинетическая кривая прироста давления Ар в ходе окисления этана. Видно, что начальный участок кривой в координатах In А / 7, t в соответствии с ( VI 1.62) изображается прямой линией. [45]
Страницы: 1 2 3 4